Zonder financiering geen innovaties
Niet vergoede gentest uit richtlijn wordt door het veld niet toegepast
Plaats een reactie
Volgens de richtlijn zou een predictieve gentest bij bepaalde typen longkanker nuttig zijn. Maar omdat financiering van de test niet structureel is geregeld, wordt de richtlijn niet nageleefd.
Een zorgaanbieder die succesvol innoveert, helpt zijn patiënten het beste. Maar de implementatie van richtlijnen voor de diagnostiek en behandeling van veelvoorkomende ziekten verloopt soms moeizaam. Dit komt door inconsistentie in de organisatie van zorg, onvoldoende samenwerkende beroepsgroepen en vooral: het ontbreken van adequate financiering.
Aan de hand van een voorbeeld laten we zien dat innovatie niet altijd wordt ondersteund door het financieringssysteem. Ons voorbeeld betreft een voorspellende test die door de richtlijn wordt geadviseerd: de EGFR-mutatieanalyse. Deze test is van belang omdat een activerende mutatie in EGFR bij patiënten met longcarcinoom voorspelt of ze zullen reageren op tyrosinekinaseremmers (EGFR: epidermal growth factor receptor). Activerende EGFR-mutaties komen meer voor bij vrouwen met een adenocarcinoom van de long, die niet of weinig hebben gerookt. Om die reden werd deze analyse vóór 2011 – toen de richtlijn van kracht werd – voornamelijk bij vrouwen uitgevoerd. De richtlijn voor behandeling van niet-kleincellig longcarcinoom adviseert echter om EGFR-mutatieanalyse uit te voeren bij alle patiënten met gemetastaseerd niet-kleincellig longcarcinoom (behalve plaveiselcelcarcinoom) die niet in aanmerking komen voor een in opzet curatieve therapie.
Om de invloed van de richtlijn te onderzoeken hebben we alle pathologielaboratoria die EGFR-mutatieanalyse uitvoeren, gevraagd gegevens aan te leveren van vóór 2011 en uit de periode 1 december 2012 tot en met 30 november 2013. De data betroffen onder meer leeftijd en geslacht van de patiënten en gegevens over de uitkomsten van EGFR-mutatieanalyse.
Nauwelijks wijziging
Vóór het invoeren van de richtlijn werden in totaal 6084 analyses naar activerende mutaties in EGFR gerapporteerd (zie tabel; de tabel geeft de aantallen van twaalf van de dertien deelnemende laboratoria).
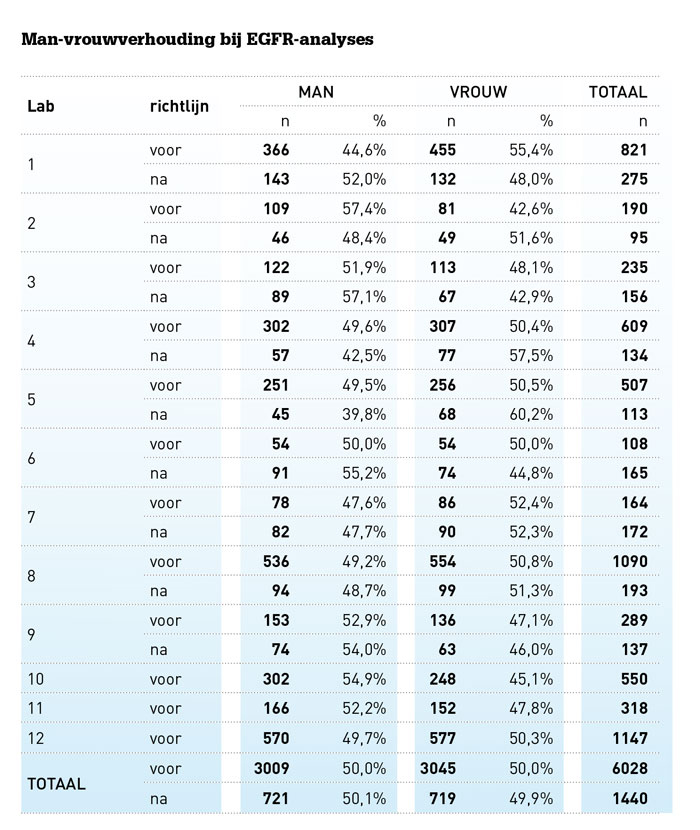
De man-vrouwverhouding was fifty-fifty. Tussen december 2012 en december 2013 zijn in totaal 1440 EGFR-mutatieanalyses verricht. De verhouding tussen mannelijke (50,1%) en vrouwelijke (49,9%) patiënten was vrijwel gelijk. Er is geen aantoonbaar verschil in selectiepatroon voor EGFR-mutatieanalyse voor en na het invoeren van de richtlijn behandeling van niet-kleincellig longcarcinoom. In de periode na invoering van de richtlijn werden 9,5 procent minder mannen getest dan op basis van de incidentie van niet-kleincellig longcarcinoom was te verwachten.
Er ontbreekt een procedure om de financïele consequenties door te lichten
Deze bevindingen wijzen erop dat de richtlijn diagnostiek en behandeling van niet-kleincellig longcarcinoom niet of nauwelijks tot een wijziging in de uitvoering van predictieve EGFR-mutatieanalyse heeft geleid. Dat impliceert dat de richtlijn niet is geïmplementeerd in de dagelijkse praktijk.
Onze studie geeft een sterke aanwijzing dat predictieve analyse naar EGFR-mutaties bij patiënten met longkanker onvoldoende wordt ingezet bij mannen, terwijl deze mutaties zeer belangrijk zijn voor de therapiekeuze. Het ontbreken van financiering van predictieve testen heeft hieraan zeker bijgedragen. Het dbc-zorgsysteem loopt dus achter bij innovaties in de geneeskunde.
Geen financiering
Hoewel in een richtlijn nieuw beleid is voorgesteld, ontbreekt een adequate procedure om de potentiële financiële consequenties op kosteneffectiviteit, zorguitkomst of dbc-rendementen door te lichten. Geneesmiddelen vallen onder de verzekerde zorg, maar hoeven in principe niet in ieder ziekenhuis vergoed te worden door de zorgverzekeraar Dit ligt vast in contractafspraken tussen zorginstelling en verzekeraar. Het dbc-zorgproductensysteem geeft ruimte aan het uitvoeren van EGFR-mutaties. Wat in de dbc-zorgproducten vergoed wordt, bepaalt de Nederlandse Zorgautoriteit op basis van beroepsrichtlijnen en afspraken met veldpartijen. Tot op heden – ruim vijf jaar na de richtlijn – is voor voorspellende analyses, zoals de EGFR-mutatieanalyse, geen afdoende financiering geregeld. Dit geldt zowel voor de ziekenhuisbudgettering als voor de contractafspraken met zorgverzekeraars. In het verleden hebben de medisch oncologen onder andere via de commissie BOM (beoordeling oncologische middelen) gesproken met het ministerie van VWS over de toelating en financiering van de dure geneesmiddelen, zoals tyrosinekinaseremmers. Dit heeft geleid tot een situatie waarbij het geneesmiddel wel wordt vergoed, maar niet de er onlosmakelijk mee verbonden zijnde nieuwe predictieve EGFR-mutatieanalyse. In de praktijk veroorzaakt dit extra druk op het budget van de klinische pathologie. Predictieve testen zouden moeten leiden tot een verruiming van de vergoedingen in het dbc-zorgproductsysteem. Nu dat niet het geval is, kan de implementatie van predictieve testen leiden tot verlieslatende dbc-zorgproducten. De predictieve testen komen bovenop de gangbare diagnostiek en moeten bij circa tien patiënten met gemetastaseerd adenocarcinoom van de long worden verricht om er één met een activerende EGFR-mutatie te identificeren.
Verhoudingsgewijs zijn de kosten voor predicitieve testen echter zeer gering in vergelijking met de kosten van het veelal dure geneesmiddel. Omdat het macrobudget van een zorginstelling maar 1 procent per jaar mag groeien en omdat financiering van de pathologie vaak indirect geregeld is via andere afdelingen, raakt het pathologiebudget onderbedeeld. Kortom, het dbc-zorgproductensysteem remt eerder de invoering van nieuwe analyses dan dat te faciliteren. Zorgwekkend is dat met de nieuwe immunotherapie die nu bij de minister in de sluis zit, wederom geen rekening wordt gehouden met financiering van nog een extra uit te voeren test.
Reactie NZa
Voor dit type onderzoek bestaat een mogelijkheid in de bestaande systematiek voor registratie en declaratie: die van de zorgprestatie/zorgactiviteit voor complexe moleculaire diagnostiek. Als die prestatie niet voldoet, zoals Vincenten e.a. beschrijven, is het van belang dat dit wordt aangegeven bij de Nederlandse Zorgautoriteit (NZa). Wij nodigen de betreffende zorgaanbieders dan ook graag uit om met ons in gesprek te gaan over de kwestie. Ook kunnen de zorgaanbieders, net als zorgverzekeraars, online een aanvraag indienen voor een nieuwe prestatie of een verbijzondering daarvan. Om registratie en declaratie van zorgproducten mogelijk of specifieker te maken. In het concrete geval lijkt een dergelijk verzoek niet eerder te zijn ingediend. Dat kan echter alsnog. In het verleden hebben soortgelijke ontwikkelingen tot een verbijzondering in de systematiek geleid. Zo zijn in 2015, voor vergelijkbaar onderzoek bij borstkanker, zorgprestaties geïntroduceerd voor de genexpressietest op basis van 70 genen (‘MammaPrint') en 21 genen (‘Oncotype DX’). Dit begint echter met een concreet verzoek van de betrokken zorgaanbieders en/of zorgverzekeraars.
Nederlandse Zorgautoriteit
Reactie longartsen
Het artikel geeft op pijnlijke wijze weer dat vergoedingensystemen en financiële structuren die niet mee-evolueren met innovaties in de medische wereld een belangrijke barrière kunnen vormen voor het tijdig brengen van nieuwe behandelingen naar patiënten. Zorgaanbieders moeten zich vergewissen van de innovatie in het medisch veld die een bijdrage leveren aan verbeterde kwaliteit van leven en overleving van patiënten met kanker.
Patiënten met longkanker hebben de laatste jaren veel baat gehad bij doelgerichte behandelingen die worden gegeven vanwege een specifieke DNA-afwijking waarvoor medicatie (targeted therapy) beschikbaar is. Door de snelle ontwikkelingen in de genomische diagnostiek van kanker is niet alleen het arsenaal aan specifieke DNA-afwijkingen toegenomen maar ook de daarbij behorende doelgerichte medicatie. Denk aan gefitinib, erlotinib en afatinib voor EGFR en crizotinib voor ALK-geactiveerde longcarcinomen. Recenter is dabrafenib met trametinib voor BRAF V600-mutatie bij longcarcinomen erbij gekomen. Ook voor andere solide tumoren zien we succesvolle behandelingen met imatinib voor KIT-gemuteerde GIST, vemurafenib voor BRAF-gemuteerde melanomen. Predictieve testen zijn dus noodzakelijk voor het welzijn van kankerpatiënten. Wij vinden daarom dat zorgaanbieders actief hun vergoedingensystemen moeten aanpassen aan deze innovaties. Dat brengt doelgerichte behandelingen (en immunotherapie) als zinnige zorg tijdig bij kankerpatiënten; het voorkomt ook dat dokters hun goed geïnformeerde patiënt het onthouden van medicatie niet meer kunnen uitleggen. Genomische testen horen in het basispakket.
Harry Groen
Franz Schramel
sectie Oncologie NVALT (Nederlandse Vereniging van artsen voor Longziekten en Tuberculose)
auteurs
Julien Vincenten, longarts, Albert Schweitzer ziekenhuis, Dordrecht
Bas van der Mierden, partner geneesmiddelenmanagement, Prometheus Health Care, Tilburg
Egbert Smit, longarts, VU Medisch Centrum, Amsterdam
Erik Thunnissen, klinisch patholoog, VU Medisch Centrum, Amsterdam
contact
e.thunnissen@vumc.nl
cc: redactie@medischcontact.nl
belangenverstrengeling
Erik Thunnissen is gesponsord door Astra Zeneca voor EGFR mutatieanalyse; heeft investigator initiated research-project gedaan over ALK IHC+ m+NSCLC gesponsord door Pfizer; heeft advisory board-functies bij MSD, BMS, Pfizer, Clovis, UKNEQAS.
Bas van der Mierden is onafhankelijk adviseur voor ziekenhuizen, farmaceutische industrie, medischetechnologiebedrijven en medischehulpmiddelbedrijven.
Egbert Smit is consultant voor Eli Lilly, heeft advisory board-functies bij Astra Zeneca, Boehringer Ingelheim, Bayer, Cellgene, Novartis, Roche-Genentech, Pfizer, BMS en wordt gesponsord voor onderzoeksprojecten door Astra Zeneca, BMS, Boehringer Ingelheim, MSD en Roche-Genentech.
Julien Vincenten meldt geen belangenverstrengeling.
Betrokkenen bij het aanleveren en verwerken van data
Antonius Ziekenhuis Nieuwegein
Alain Kummer, afdeling Pathologie
Catharina-Wilhelmina Ziekenhuis Nijmegen
Clemens Prinsen, afdeling Pathologie
Diakonessenhuis Utrecht
Joost van Gorp, afdeling Pathologie
Joost Oudejans, afdeling Pathologie
Erasmus MC, Rotterdam
Winand Dinjens, afdeling Pathologie
Isala Zwolle
Nils ’t Hart, afdeling Pathologie
Jeroen Bosch Ziekenhuis, Den Bosch
Adriaan van den Brule, afdeling Pathologie
Laboratorium Pathologie Oost Nederland
Robert van der Geize, afdeling Pathologie
Sietske Riemersma, afdeling Pathologie
Maastricht UMC+
Ernst-Jan Speel, afdeling Pathologie
Anne-Marie Dingemans, afdeling Longziekten
NKI
Petra Nederlof, afdeling Pathologie
Radboudumc Nijmegen
Bastiaan Tops, afdeling Pathologie
Monika Looijen, afdeling Pathologie
Erik van der Heijden, afdeling Longziekten
UMC Groningen
Ed Schuuring, afdeling Pathologie
Harry Groen, afdeling Longziekten
UMC Utrecht
Sander Smits, afdeling Pathologie
Aryan Vink, afdeling Pathologie
Wendy de Leng, afdeling Pathologie
VUmc, Amsterdam
Birgit Witte, afd. Epidemiologie en Biostatistiek
Daniëlle Heideman, afdeling Pathologie
Joop de Langen, afdeling Longziekten
Peter Snijders, afdeling Pathologie
download dit artikel (pdf)- Er zijn nog geen reacties















