Endoscopisten herkennen invasieve carcinomen nog onvoldoende
Behandeling vroeg stadium darmkanker vraagt om multidisciplinaire samenwerking
Plaats een reactie
Dankzij het bevolkingsonderzoek wordt darmkanker steeds vaker in een vroeg stadium gevonden. Toch zijn er bij het herkennen van invasieve carcinomen en bij de keuze van behandeling veel valkuilen.
Met de invoering van het bevolkingsonderzoek naar darmkanker in 2014 is het aantal patiënten met vroeg stadium (T1) darmkanker (colorectaal carcinoom, CRC) de afgelopen jaren sterk toegenomen. Juist de carcinomen met alleen invasie in de submucosa (T1-carcinomen) hebben een laag risico op lymfkliermetastasen van 7-9 procent en lenen zich bij uitstek voor een lokale behandeling. Om tot succesvolle lokale behandeling te komen zijn meerdere stappen noodzakelijk. Allereerst moet de poliep als potentieel invasief worden herkend zodat speciale endoscopische resectietechnieken kunnen worden toegepast. Vervolgens moet de patholoog het risico op lymfkliermetastasen betrouwbaar inschatten. Na multidisciplinair overleg kan vervolgens, in overleg met de patiënt, het juiste vervolgbeleid worden ingezet. Bij elk van deze stappen is nog veel ruimte voor verbetering.
Recentelijk hebben twee Nederlandse onderzoeken aangetoond dat endoscopisten op dit moment de invasieve carcinomen zeer matig herkennen (slechts 25-39% wordt herkend).
Dit heeft vaak tot gevolg dat deze T1-carcinomen vaak niet in één stuk worden verwijderd (‘en bloc’-resectie), waardoor onzekerheid ontstaat bij pathologische beoordeling van de radicaliteit en de aanwezigheid van histologische risicofactoren voor lymfekliermetastasen.
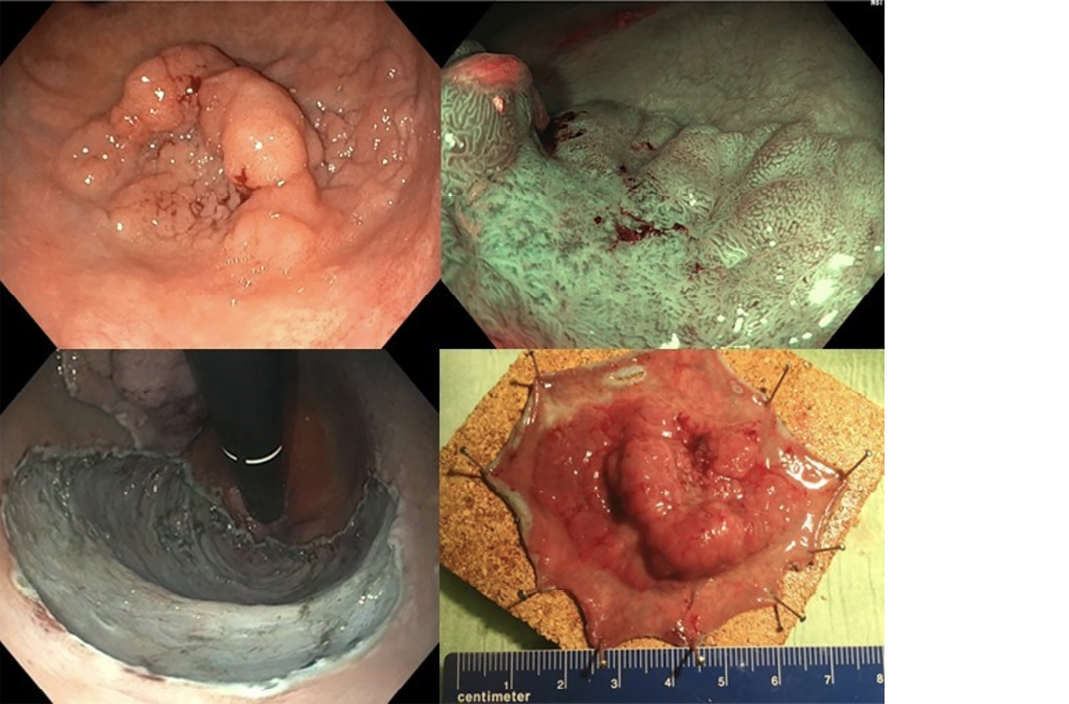
Met behulp van het Optical-model van de T1-CRC-werkgroep kan het risico op maligniteit tijdens de beoordeling van een poliep worden ingeschat. Daarbij wordt onder andere gekeken naar de vorm en het uiterlijk van de poliep (oppervlaktepatronen). Met de aan- of afwezigheid van specifieke kenmerken wordt vervolgens de kans op aanwezigheid van invasief carcinoom ingeschat. Als dit boven de 10 procent is, zou men zeker een ‘en bloc’-resectietechniek moeten overwegen.
Er is net een grote training geweest van veel Nederlandse endoscopisten, en het is nu afwachten of de herkenning van T1-CRC’s verbetert.
Steeds meer patiënten besluiten geen segmentresectie te laten verrichten
Complexe techniek
Een grote groep patiënten met een T1-carcinoom kan met een lokale behandeltechniek curatief worden behandeld. In het rectum is transanale endoscopische microchirugie (TEM/TAMIS) een bekende chirurgische methode om T1-CRC’s lokaal te verwijderen. Met de introductie van endoscopische resectietechnieken, zoals endoscopische submucosale dissectie (ESD) en de endoscopische full-thickness-resectie (eFTR) speelt de mdl-arts ook een belangrijk rol in de lokale behandeling van patiënten met een T1-CRC.
Bij de in Japan ontwikkelde ESD-techniek wordt met behulp van een al dan niet viskeuze vloeistof de diepe slijmvlieslaag (submucosa) onder de poliep opgeblazen, zodat er een scheidingsvlak met de spierlaag ontstaat. Vervolgens wordt heel voorzichtig de poliep van de spierlaag ‘afgepeld’. Dit is een zeer complexe techniek om te leren en kent een aanzienlijke leercurve. ESD biedt de mogelijkheid om grote poliepen en oppervlakkige T1-carcinomen van meerdere centimeters radicaal te verwijderen. In Nederland wordt momenteel een gerandomiseerde studie (de Triassic-studie) verricht waarbij TAMIS wordt vergeleken met een ESD voor poliepen en T1-CRC in het rectum.
Als er sprake is van diepere submucosale invasie, wordt de kans op een radicale resectie erg klein. Dan is een lokale full-thickness-resectie nodig, waarbij alle wandlagen worden meegenomen in de resectie. Er zijn verschillende technieken waarmee een lokale full-thickness-resectie kan worden uitgevoerd. Dit kan met een coloscopisch ondersteunde laparoscopische wigresectie. Hierbij wordt onder endoscopisch zicht een chirurgische wigresectie verricht; dit om er zeker van te zijn dat de laesie goed in de wig is ingesloten.
Endoscopische full-thickness-resectie is een andere techniek. Met deze techniek wordt de poliep in een op de scoop gemonteerde kap getrokken, daarna wordt een clip afgeschoten, en vervolgens wordt met een lis het deel boven de clip verwijderd. Deze laatste techniek is vooral geschikt voor de kleinere laesies (maximaal 15 mm). Tegenwoordig worden deze lokale resecties bij voorkeur uitgevoerd in centra die op dit vlak speciale expertise hebben ontwikkeld.
Risico op lymfkliermetastasen
Na een ‘en bloc’ endoscopische resectie, waarbij de kans op een histologisch radicale resectie (R0) het hoogst is, is het aan de patholoog om vervolgens in te schatten hoe groot het risico op lymfkliermetastasen is. CT- en MRI-scans zijn hiervoor ontoereikend gebleken. De patholoog schat dit risico in aan de hand van een aantal histologische kenmerken zoals de aanwezigheid van slechte differentiatie, lymfovasculaire invasie, of veel losse tumorcellen (tumor budding). Als er geen risicofactoren zijn, is het risico op metastasering kleiner dan 1 procent. Men spreekt dan van een laagrisico-T1-CRC. Deze patiënten behoeven geen aanvullende chirurgische behandeling en ook geen radio-oncologische follow-up. Als er een of meerdere risicofactoren aanwezig zijn, spreekt men van een hoogrisico-T1-CRC en wordt doorgaans een aanvullende oncologische segmentresectie met meenemen van de lymfklieren verricht. De voorspellende waarde van de individuele histologische kenmerken is echter laag en het risico op lymfkliermetastasen in de hoogrisico-T1-CRC-groep is derhalve maar 10 procent. Daarnaast bestaat er onder pathologen verschil in beoordeling van de histologische risicokenmerken (praktijkvariatie), zoals die in het vaststellen van lymfovasculaire invasie. Er lopen inmiddels meerdere initiatieven om dit te verbeteren. Daarnaast zijn er modellen in de maak die – anders dan de huidige praktijk – niet aangeven of iemand een hoog of laag risico heeft op lymfkliermetastasen, maar dit risico weergeven in een percentage. Hierdoor is het veel beter mogelijk om met de specifieke patiënt de waarde van een aanvullende oncologische resectie te bespreken en daarmee maatwerk te leveren in het bepalen van het vervolgbeleid.
Multidisciplinaire samenwerking
Met de huidige risicostratificatie zal 90 procent van de hoogrisico-T1-CRC-groep een segmentresectie ondergaan zonder dat er resterend tumorweefsel zal worden gevonden. Tegenwoordig besluiten dan ook steeds meer patiënten om deze ingreep niet te laten verrichten, zeker als de chirurgie een grotere impact heeft zoals in het rectum of bij fragiele patiënten. In plaats daarvan kiezen ze voor intensieve follow-up. Het is echter nog onduidelijk wat de oncologische uitkomst is, en hoe vaak patiënten een (lokaal) recidief ontwikkelen. Via de T1-werkgroep loopt nu een prospectief onderzoek om dit beter in kaart te brengen. Daarnaast loopt er een gerandomiseerde studie die kijkt of na een geslaagde lokale resectie van een hoogrisico-T1-rectumcarcinoom aanvullende chemoradiatie niet even effectief kan zijn als een oncologische resectie (Tesar-studie).
Het onderwerp van de T1-CRC’s vraagt om multidisciplinaire samenwerking tussen mdl-artsen, pathologen, chirurgen en radiologen. Dit gebeurt nu ook via een Nederlandse samenwerking, genaamd de T1-CRC-werkgroep waaraan specialisten van 48 ziekenhuizen zijn aangesloten. Binnen dit platform wordt onderzoek verricht om belangrijke knelpunten op te lossen.
Auteurs
Jurjen Boonstra, maag-, darm- en leverarts, LUMC, Leiden
Frank ter Borg, maag-, darm- en leverarts, Deventer Ziekenhuis
Leon Moons, maag-, darm- en leverarts, UMC Utrecht
Wouter de Vos tot Nederveen Cappel, maag-, darm- en leverarts, Isala Zwolle
Contact
cc: redactie@medischcontact.nl
Download dit artikel (PDF)- Er zijn nog geen reacties
















