Auto-immuunziekten in de hersenen: een bont palet
Variëteit maakt tijdige diagnose auto-immuunencefalitis tot een uitdaging
Plaats een reactie
Sinds 2007 heeft het onderzoek naar auto-immuunencefalitis een hoge vlucht genomen. Daardoor krijgen voorheen mysterieuze ziektebeelden nu een correcte diagnose en behandeling. Dat is extra belangrijk omdat meer dan 80 procent van de patiënten binnen een jaar goed herstelt.
Auto-immuunencefalitis is een verzamelnaam voor hersenontstekingen die worden veroorzaakt door het eigen immuunsysteem van een patiënt. Het is een zeldzame aandoening: in Nederland worden jaarlijks honderd tot honderdvijftig nieuwe patiënten gediagnosticeerd.
Naar verwachting blijft dat aantal stijgen, door betere herkenning, ontdekking van nieuwe antistoffen, en als ongewenst neveneffect van de bredere toepassing van nieuwe antitumorbehandelingen. Over dat laatste verderop in dit artikel meer.
Er zijn inmiddels meer dan tien verschillende soorten auto-immuunencefalitiden getypeerd. Het onderzoek heeft sinds de ontdekking in 2007 van een van deze soorten, anti-NMDAR-encefalitis, een enorme vlucht genomen.1 Dankzij deze fascinerende ontwikkeling kunnen we voorheen onbegrepen neurologische en neuropsychiatrische ziektebeelden nu wel op juiste wijze diagnosticeren en behandelen. Snelle herkenning van deze ziektes is uitermate belangrijk, omdat de meerderheid van de patiënten goed reageert op behandeling met immuunonderdrukkende middelen én omdat vroeg starten met behandeling resulteert in een betere kwaliteit van leven op de lange termijn voor patiënten.
Variëteit aan syndromen
Het tijdig herkennen van een patiënt met auto-immuunencefalitis blijft een uitdaging gezien de variëteit aan klinische syndromen, van jong tot oud. Ook zijn de klachten niet altijd neurologisch van aard, waardoor patiënten soms eerst terechtkomen bij andere specialisten. Bijvoorbeeld bij een psychiater, vanwege psychotische verschijnselen bij een patiënt met een anti-NMDAR- of anti-AMPAR-encefalitis; bij een geriater, vanwege een snel progressieve dementie bij een oudere patiënt met een anti-NMDAR-, anti-LGI1- of anti-GABABR-encefalitis; bij een mdl-arts, vanwege diarree en gewichtsverlies bij een patiënt met een anti-DPPX-encefalitis. Daarom is het ook voor deze specialismen belangrijk om deze aandoeningen te herkennen.
De diagnose wordt weleens onterecht verworpen omdat er niet altijd tekenen van ontsteking aanwezig hoeven te zijn op de MRI van de hersenen of in het hersenvocht. Verder verschilt de gevoeligheid van het testen in hersenvocht versus serum per antistof. Als een minder geschikt monster wordt ingestuurd, kan de diagnose worden gemist. De diagnostische criteria voor auto-immuunencefalitis zijn gepubliceerd in 2016.2 Daarin staan handvatten voor een juiste diagnose en wordt ook ruimte geboden om een waarschijnlijke diagnose te stellen. In afwachting van antistofdiagnostiek kan de behandeling al starten.
Het cognitief herstel vergt maanden tot jaren
Meestvoorkomende vormen
In Nederland komen anti-NMDAR- en anti-LGI1-encefalitis het meeste voor, gevolgd door anti-IgLON5-, anti-CASPR2- en anti-GABABR-encefalitis. Bij een anti-NMDAR-encefalitis ontstaan er snel progressieve psychiatrische klachten en geheugenstoornissen. In de dagen tot weken daarna ontwikkelen de meeste patiënten epileptische aanvallen, een verlaagd bewustzijn, abnormale bewegingen en autonome stoornissen met centrale hypoventilatie. Het gaat om een ernstige aandoening, waarbij tot 75 procent van de patiënten wordt opgenomen op de intensive care, hoewel dit percentage de laatste jaren daalt door snellere herkenning en start van behandeling.
Anti-NMDAR komt op alle leeftijden voor, maar vooral bij vrouwen in de vruchtbare leeftijd en bij kinderen. In ruim een derde van de gevallen wordt een tumor aangetoond, meestal een ovariumteratoom; de gynaecoloog verwijdert de tumor om zo de activatie van het immuunsysteem tot stilstand te brengen. Snelle behandeling met immuuntherapie en minder ernstige ziekte geven een grotere kans op een betere uitkomst. Ondanks de ernst van de ziekte herstelt ruim 80 procent van de patiënten na behandeling goed. Het herstel kan echter tot wel twee jaar duren en soms langer. In tegenstelling tot andere neurologische aandoeningen kunnen patiënten in de jaren nadien nog verder verbeteren.3
Anti-LGI1-encefalitis komt vooral voor bij oudere patiënten (mediane leeftijd 60 jaar); binnen weken tot maanden ontwikkelen ze epilepsie, geheugen- en gedragsproblemen. De epileptische aanvallen ontstaan meestal in het begin, en kunnen bestaan uit faciobrachiale dystone aanvallen (FBDS), die ziektespecifiek zijn, en focale epileptische aanvallen. Beide typen worden geregeld gemist of als ‘functioneel’ geduid, omdat het subtiele aanvallen betreft, er gelijkenis is met paniekaanvallen en omdat de aanvallen vaak niet zichtbaar zijn op het eeg. Ongeveer 65 procent van de patiënten heeft een laag natrium. Een onderliggende maligniteit wordt zelden gevonden. Na behandeling met immuuntherapie verdwijnt de epilepsie binnen dagen tot weken, maar het cognitief herstel vergt maanden tot jaren en er kunnen cognitieve restklachten blijven.
Epilepsie
Naast de typische klachten van een auto-immuunencefalitis komen ook andere symptomen voor. In Nederland hebben we in samenwerking met de epilepsiecentra onderzoek gedaan bij 582 patiënten met (chronische) focale epilepsie zonder tekenen van encefalitis. Bij twintig patiënten (3,4%) werden neuronale antistoffen gevonden. Dit is een klein, maar relevant deel omdat deze patiënten baat hebben bij immuuntherapie. De klinische ACES-score is ontwikkeld om precies die patiënten met focale epilepsie te selecteren bij wie antistofdiagnostiek nuttig is. In de ACES-score zijn de volgende risicofactoren opgenomen: 1. (milde) cognitieve symptomen; 2. (milde) gedragsveranderingen; 3. autonome symptomen; 4. spraakproblemen; 5. auto-immuunziekte; en 6. MRI-hyperintensiteit in de mesiale temporaalkwab. Elke factor levert één punt op en bij een ACES-score gelijk aan of hoger dan 2 is antistofdiagnostiek zinvol. Bij die score vind je alle patiënten, maar heeft meer dan 80 procent geen diagnostiek nodig.4
Bij een nieuw ontstane status epilepticus (NORSE) heeft meer dan een derde van de patiënten een auto-immuunetiologie en is het advies, bij ontbreken van een andere oorzaak, altijd te testen op antistoffen tegen encefalitis.

Dementie en bewegingsstoornissen
Bij patiënten met dementieklachten is het advies om de diagnose auto-immuunencefalitis te overwegen bij een snel progressieve cognitieve achteruitgang, epileptische aanvallen – let op subtiele focale aanvallen – en bevindingen op de MRI-hersenscan of in het hersenvochtonderzoek die kunnen wijzen op neuro-inflammatie. Het is belangrijk te weten dat biomarkers voor dementie, waaronder ook tau en 14-3-3, afwijkend kunnen zijn bij patiënten met een auto-immuunencefalitis. Op grond van uitsluitend deze bevindingen is het niet mogelijk om de diagnose auto-immuunencefalitis te verwerpen.
Binnen de bewegingsstoornissen komt er steeds meer aandacht voor auto-immuunencefalitis als oorzaak van verschillende type stoornissen. Enkele interessante patiënten vanuit onze praktijk ter illustratie. Een vrouw van 66 jaar met frequente verkrampingen in gelaat en arm, meer dan honderd keer per dag, die na een jaar werden herkend als FBDS, waarna de diagnose anti-LGI1-encefalitis werd gesteld. Een man van 58 jaar die bij het opstaan in de wachtkamer dronken leek met een onduidelijke spraak en een zwalkend looppatroon, maar wiens klachten zich binnen enkele minuten herstelden; na aanvullend bloedonderzoek bleek het te gaan om een episodische ataxie in het kader van een anti-CASPR2-encefalitis. Een man van 60 jaar met hemichorea, verhoogde valneiging en al jaren bestaande slaapapneu; deze bleken veroorzaakt door de aanwezigheid van anti-IgLON5-antistoffen.
Deze beelden zijn vaak lastig te herkennen, omdat er een grote variatie is in het type bewegingsstoornissen, het ziektebeloop langzaam progressief kan zijn en het geregeld oudere patiënten betreft, waardoor de gedachte eerder uitgaat naar een neurodegeneratief ziektebeeld.
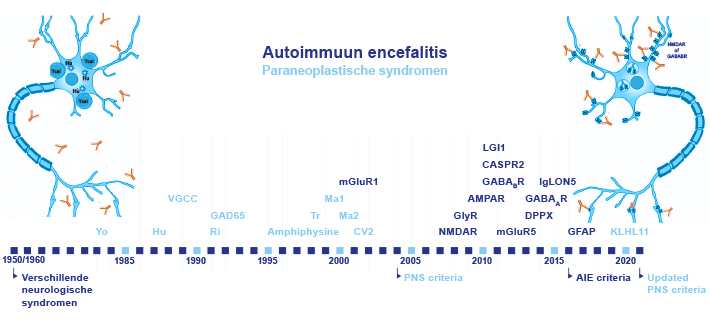
Paraneoplastische syndromen
In de jaren vijftig en zestig van de vorige eeuw zijn voor het eerst patiënten met zeldzame paraneoplastische neurologische fenomenen beschreven, dat wil zeggen dat ze neurologische klachten ontwikkelden die samenhingen met kanker maar die niet direct door de tumor werden veroorzaakt. Het waren patiënten met bijvoorbeeld longkanker die snel progressieve cognitieve stoornissen, psychiatrische symptomen, gedragsstoornissen en epileptische insulten ontwikkelden, klinisch passend bij een limbische encefalitis. Andere patiënten kregen progressieve spierzwakte, als uiting van een paraneoplastisch Lambert-Eaton myastheen syndroom.
Paraneoplastisch neurologische syndromen (PNS) komen voor bij 1 procent van alle kankerpatiënten, echter vaker bij sommige tumoren, zoals kleincellig longcarcinoom of thymoom. Ongeveer twintig jaar later werden de eerste paraneoplastische antistoffen ontdekt, zoals anti-Yo en anti-Hu, wat grote verwachtingen creëerde voor effecten van de behandeling van deze syndromen. De respons op immuunonderdrukkende therapie valt tot op de dag van vandaag helaas tegen, vooral bij de patiënten met verschijnselen in het brein, zoals cerebellaire degeneratie of limbische encefalitis. Dat komt doordat de klassieke paraneoplastische antistoffen niet direct ziekmakend zijn, maar slechts biomarkers: de antistoffen zijn gericht tegen intracellulaire eiwitten. De diagnostische criteria voor PNS zijn onlangs gereviseerd, waarbij je op basis van het klinisch beeld, de aan- of afwezigheid van een antistof en/of onderliggende tumor tot een PNS-Care Score komt waarmee de diagnose met een bepaalde zekerheid wordt gesteld of wordt verworpen.5
De recentelijk ontdekte soorten van auto-immuunencefalitis reageren in de meeste gevallen juist overweldigend goed op afweeronderdrukkende therapie. Dit komt doordat de neuronale antistoffen die de auto-immuunencefalitis veroorzaken, zich richten tegen eiwitten die zich op de celmembraan bevinden (extracellulair) en direct aangrijpen op de functie van deze eiwitten. De ziektebeelden bij neuronale antistoffen zijn diverser dan bij de paraneoplastische antistoffen, komen op alle leeftijden voor en zijn niet altijd snel progressief. Snelle behandeling kan niet alleen langdurige opnames en overlijden voorkómen, maar ook leiden tot compleet of gedeeltelijk herstel.
Uitlokker
Auto-immuunencefalitis houdt minder vaak dan PNS verband met een kwaadaardige tumor. Zo kan, naast een tumor, ook een herpesencefalitis uitlokker zijn van een auto-immuunencefalitis. Bij 25 procent van de patiënten die een herpesencefalitis hebben doorgemaakt, treedt na drie tot acht weken een klinische verslechtering op of ontstaan nieuwe neuropsychiatrische klachten, waarbij het meestal een anti-NMDAR-encefalitis betreft.
Een andere uitlokkende factor houdt verband met de ontwikkeling van nieuwe antitumorbehandelingen, zoals immune checkpoint inhibitors en chimere antigeenreceptor (CAR)-T-celtherapie. Deze revolutionaire therapieën maken het mogelijk dat tumorcellen niet meer kunnen ontsnappen aan het afweersysteem. Ze hebben echter een onverhoopte bijwerking, zoals geïllustreerd wordt door meerdere publicaties over patiënten die een auto-immuunencefalitis of een PNS ontwikkelden tijdens behandeling met immune checkpoint inhibitors. Bij de overige patiënten is er geen bekende uitlokkende factor voor de auto-immuunencefalitis; daar spreken we van een idiopathische vorm.
De respons op immuunonderdrukkende therapie valt helaas tegen
Behandeling en prognose
Auto-immuunencefalitis is over het algemeen goed te behandelen met medicijnen die de afweer onderdrukken. De aangewezen eerstelijnsbehandeling bestaat uit intraveneuze methylprednisolon, vaak in combinatie met intraveneuze immunoglobulines. Als de patiënt in de eerste weken onvoldoende verbetert, begint aanvullend een tweedelijnsbehandeling: rituximab, cyclofosfamide of beide gecombineerd. Bij een onderliggende tumor is tumorbehandeling essentieel. Als de encefalitis de oorzaak is van een slechte Karnofsky performance score, dan mag dit geen reden zijn om de tumor niet te behandelen. De behandeling van symptomen gebeurt met bijvoorbeeld anti-epileptica of antipsychotica. Na de acute behandeling zal op basis van het recidiefrisico wel of niet worden gestart met onderhoudsbehandeling met immuunonderdrukkers.
Patiënten worden in een multidisciplinaire setting behandeld, in samenwerking met de psychiater, gynaecoloog/oncoloog, internist-immunoloog, intensivist, en als het kinderen betreft de kinderarts. Na de acute fase is er samenwerking met de revalidatiearts, om de patiënten zo goed mogelijk te begeleiden bij het vaak langdurige herstel. De prognose is in het algemeen goed; meer dan 80 procent van de patiënten kan na een jaar zelfstandig functioneren. Alhoewel sommige patiënten cognitieve restklachten, vermoeidheid, blijvende gedragsveranderingen en stemmingsklachten houden na het doormaken van een auto-immuunencefalitis.
Omdat de gevolgen voor patiënten met auto-immuunencefalitis nog onvoldoende in kaart zijn gebracht, loopt op dit moment de Promise-studie in het expertisecentrum voor auto-immuunencefalitis in het Erasmus MC. In dit onderzoek kijken we naar de effecten op cognitie, stemming, vermoeidheid, dagelijks functioneren en kwaliteit van leven. Met deze studie gaan we een instrument ontwikkelen waarmee we het klachtenbeloop in de tijd kunnen meten. Dit instrument kunnen we dan gebruiken om verschillende therapieën te vergelijken, en daarmee de toekomstige behandeling te verbeteren.
auteurs
Juna de Vries, neuroloog, Erasmus MC Rotterdam
Maarten Titulaer, neuroloog, Erasmus MC Rotterdam
contact
m.titulaer@erasmusmc.nl
cc: redactie@medischcontact.nl
Voetnoten
1. Dalmau, J., et al., Paraneoplastic anti-N-methyl-D-aspartate receptor encephalitis associated with ovarian teratoma. Ann Neurol, 2007. 61(1): p. 25-36.
2. Graus, F., et al., A clinical approach to diagnosis of autoimmune encephalitis. Lancet Neurol, 2016. 15(4): p. 391-404.
3. Titulaer, M.J., et al., Treatment and prognostic factors for long-term outcome in patients with anti-NMDA receptor encephalitis: an observational cohort study. Lancet Neurol, 2013. 12(2): p. 157-65.
4. de Bruijn, M., et al., Antibodies Contributing to Focal Epilepsy Signs and Symptoms Score. Ann Neurol, 2021. 89(4): p. 698-710.
5. Graus, F., et al., Updated Diagnostic Criteria for Paraneoplastic Neurologic Syndromes. Neurol Neuroimmunol Neuroinflamm, 2021. 8(4).
Lees ook- Er zijn nog geen reacties

















