Nieuwe techniek introduceren? Weeg eerst de risico’s
Check voorafgaand aan elke nieuwe medische interventie eerst de veiligheid
1 reactie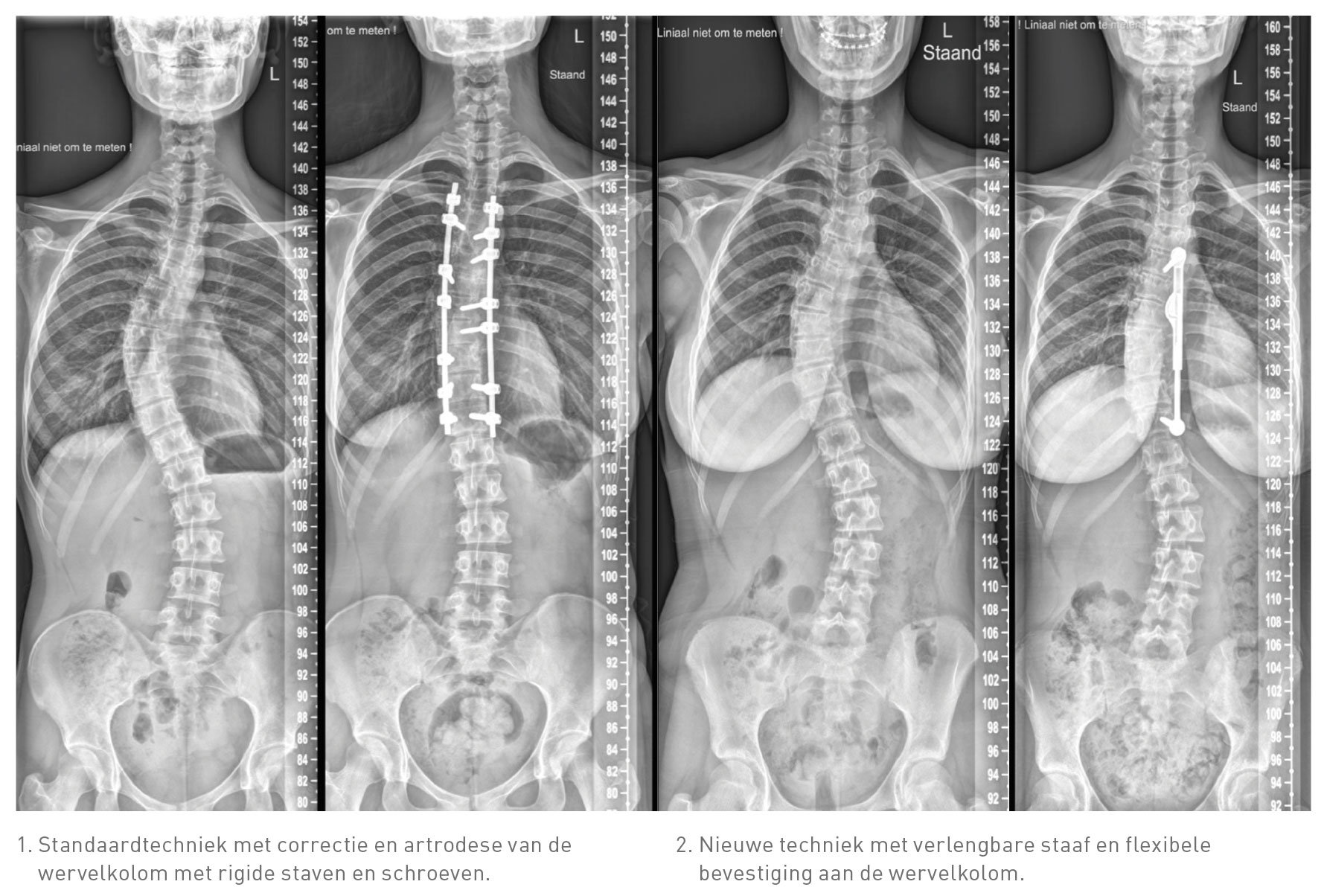
Het introduceren van een nieuwe medische techniek is een lastig proces met vele valkuilen. Een goede risicoanalyse kan veel ellende voorkomen.
De laatste decennia zijn veel nieuwe medische interventies ontwikkeld die de kwaliteit van zorg kunnen verbeteren. Aan deze interventies kleven echter ook risico’s. De problematiek rondom hartklepprotheses, lekkende PIP-borstimplantaten, metaal-op-metaalheupprotheses en, meer recentelijk, de problematische introductie van de cryoballonkatheter voor de behandeling van atriumfibrilleren illustreert dit.1-6
Terwijl de nieuwe behandelmethode met de cryoballonkatheter nog experimenteel was, verving deze al de reguliere behandeling met radiofrequente ablatie. NRC Handelsblad concludeerde dat patiënten onwetend deelnemer waren aan een medisch-wetenschappelijk onderzoek.6 Er volgden Kamervragen aan toenmalig minister Schippers en een onderzoek door de Inspectie Gezondheidszorg en Jeugd. Hierna verscheen een krantenartikel met als ondertitel: ‘De inspectie legt maatregelen op (…) na het niet zorgvuldig introduceren van een nieuwe behandeling tegen hartritmestoornissen’.7
Bij de introductie van een nieuwe medische interventie zijn er naast de patiëntgebonden risico’s, ook risico’s op reputatieschade en daarmee potentiële financiële gevolgen voor de instelling. De medische innovaties zijn nodig om de stijgende lijn in zorgkwaliteit voort te zetten. Maar er moet een juiste verhouding zijn tussen de mogelijkheid tot innovatie en veiligheid. Een praktijkvoorbeeld laat zien hoe de introductie van een nieuwe medische interventie in goede banen is te leiden.
Leidraden
Terwijl voor nieuwe geneesmiddelen een uitgebreid houvast beschikbaar is in de vorm van wetgeving en richtlijnen, is dat voor medische interventies pas de laatste jaren in ontwikkeling. De Federatie Medisch Specialisten heeft hiervoor leidraden ontwikkeld, zoals ‘Verantwoordelijkheid medisch specialisten bij onderhoud en beheer van medische apparatuur’ (2012) en ‘Verantwoordelijkheid medisch specialisten bij de aanschaf en ingebruikname van medische apparatuur’ (2013). In 2014 volgde de leidraad ‘Nieuwe Interventies in de Klinische Praktijk’ (NIKP).8 Hierin staat hoe een nieuwe interventie (NI) zorgvuldig en veilig kan worden ingevoerd.
De leidraad NIKP beschrijft in een stappenplan de aspecten die voorafgaande aan de introductie van een NI moeten worden geëvalueerd: de innovatieklasse (experimenteel of lokaal nieuw met ervaring elders), de effectiviteit, risico’s (veiligheid, maar ook risico’s voor de organisatie en de impact op het budget), training van zorgprofessionals en als laatste monitoring en evaluatie van de resultaten. Een belangrijk onderdeel van het stappenplan is de prospectieve risico-inventarisatie (PRI). Hierbij bepaalt een multidisciplinair team in een vroeg stadium de risico’s van een interventie en stelt maatregelen op om ze weg te nemen of te verminderen. De leidraad beoogt expliciet om dit proces te begeleiden zonder onnodige barrières op te werpen.
Groot litteken
Adolescente idiopathische scoliose (AIS) is een deformiteit van de wervelkolom. De huidige standaardbehandeling bestaat uit chirurgische correctie van de scoliose en een permanente artrodese, waarbij de wervelkolom wordt vastgezet met een rigide constructie van metalen staven en schroeven (zie foto 1). De operatie duurt enkele uren en laat een groot litteken achter. Na de operatie verblijven patiënten vier tot zeven dagen in het ziekenhuis om te herstellen.
Er zijn nu echter chirurgische technieken ontwikkeld die de scoliose corrigeren zonder de noodzaak van een artrodese. Een van deze technieken is een verlengbare staaf die met twee schroeven aan de wervelkolom wordt verbonden (zie foto 2). Postoperatief is het implantaat te verlengen door lichamelijke oefeningen uit te voeren, zodat de scoliose stapsgewijs wordt gecorrigeerd. Deze operatietechniek is minder invasief en de flexibiliteit van de wervelkolom blijft behouden doordat de schroeven flexibel kunnen bewegen ten opzichte van de staaf. Om de potentiële introductie van dit nieuwe implantaat te evalueren werd de leidraad NIKP gevolgd.
Toegevoegde waarde
Bij enkele tientallen patiënten in Europa was al ervaring opgedaan met het implantaat en het had een CE-keurmerk. Het behoorde echter niet tot de standaard chirurgische behandeling van AIS. Op basis van de genoemde voordelen had het implantaat mogelijk een toegevoegde waarde ten opzichte van de conventionele chirurgische techniek. Na overleg met de afdelingen Inkoop en Financiën, de operatiekamers en de kinderafdeling werd besloten om de nieuwe interventie in de praktijk toe te passen bij een klein aantal patiënten. Voor de PRI werden naast de orthopedisch chirurgen verschillende professionals geraadpleegd, onder wie een traumachirurg, een klinisch fysicus, een onderzoeker, een kwaliteitsmedewerker, de leverancier, de fabrikant, een inkoopmedewerker en fysiotherapeuten.
In totaal werden twaalf risico’s geïdentificeerd
In totaal werden twaalf risico’s geïdentificeerd en ingedeeld in drie categorieën: preoperatief, intra-operatief en postoperatief. Enkele voorbeelden van de geïdentificeerde potentiële risico’s zijn het ontbreken van bepaalde maatvoeringen, verkeerde indicatiestelling, onjuiste plaatsing van het implantaat of gebrekkige uitvoering van de postoperatieve oefeningen. Voor elk risico werd een beheersmaatregel opgesteld, zoals het vooraf kunnen inmeten van de juiste implantaatmaat, intraoperatieve deelname van een ervaren orthopedisch chirurg gespecialiseerd in de behandeling van AIS en intensieve begeleiding van de patiënten door fysiotherapeuten van het ziekenhuis. Daarnaast was er een mogelijk risico op materiaalbreuk: een worstcasescenario.
Flexibiliteit
Om dit laatste risico verder te analyseren werd het implantaat getest in wervelkolommen van overleden humane donoren en varkens.9 Het experiment toonde aan dat wervelkolommen met het nieuwe implantaat flexibeler waren dan met de standaard chirurgische methode. De flexibiliteit werd echter toch enigszins beperkt, waardoor er in vivo waarschijnlijk toch enige belasting van het implantaat zal optreden. Op termijn kan hierdoor een risico op materiaalbreuk ontstaan. Het implantaat kon wel langduriger grotere krachten weerstaan dan de conventionele staven en schroeven. Daarom werd bij de introductie in de klinische praktijk besloten tot intensievere radiologische controle dan de standaardbehandeling. Bovendien werd ingeschat dat bij eventuele materiaalbreuk altijd revisie middels conventionele chirurgie mogelijk zou zijn.
De huidige regels voor medische hulpmiddelen zijn verouderd
Zoals de risico’s verschillende vormen kunnen aannemen, zo variëren ook de beheersmaatregelen om de risico’s te minimaliseren. Voor de nieuwe operatietechniek bij AIS werd op basis van de PRI en het biomechanisch onderzoek besloten om het implantaat toe te passen in onderzoeksverband. Aan de hand van een kleinschalig prospectief cohortonderzoek zouden de risico’s en de effectiviteit van de behandeling worden geëvalueerd. Het onderzoeksbureau en de medisch-ethische toetsingscommissie gingen hiermee akkoord en de Vereniging van Scoliosepatiënten stemde in met de manier waarop proefpersonen werden geïnformeerd.
Eerst kleinschalig
Omdat er medische en niet-medische risico’s (logistiek, financieel, reputatie) zijn, is de inzet nodig van collega’s met kennis en kunde van andere medische en niet-medische afdelingen. Het spreekt voor zich dat het aanbevolen is om risicovolle nieuwe interventies waar nog weinig ervaring mee is eerst kleinschalig toe te passen. Ondanks een zorgvuldige PRI kunnen immers altijd risico’s over het hoofd worden gezien die pas na de introductie van de nieuwe interventie aan het licht komen.
Het volgen van de leidraad NIKP heeft in het praktijkvoorbeeld niet geleid tot onnodige tijd- en energieverspilling. Met alle betrokken partijen zijn de risico’s in kaart gebracht en er is een duidelijk introductieplan opgesteld. Daarmee konden veel risico’s worden beperkt en kon de introductie van de nieuwe interventie in goede banen worden geleid. Op basis van de onderzoeksresultaten zullen we weten of de nieuwe behandelmethode een effectieve en veilige optie is voor deze patiëntengroep en of het daadwerkelijk de beoogde voordelen biedt.
Nieuwe regelgeving
De huidige regels voor medische hulpmiddelen zijn verouderd en bieden geen verplichtingen omtrent effectiviteit of veiligheid. De Europese Unie heeft daarom nieuwe regelgeving (EU verordening 2017/745) opgesteld die ervoor moet zorgen dat zorgprofessionals kunnen vertrouwen op de kwaliteit van een nieuw medisch hulpmiddel.10 Deze verordening wordt in mei 2020 van kracht voor medische hulpmiddelen (zoals borstimplantaten of heupprothesen) en in mei 2022 voor in-vitrodiagnostica (zoals bloedglucosemeters of zwangerschapstesten). Belangrijke verbeteringen zijn:
- de fabrikant moet een klinische evaluatie uitvoeren bij hulpmiddelen met een potentieel hoog risico voor patiënten;
- er komen controles op instanties die nieuwe technieken keuren;
- er komt een EU-brede database voor medische hulpmiddelen.
Mandarijnennetje
De onderzoeksopzet voor de klinische evaluatie moet wetenschappelijk en ethisch worden getoetst om de betrouwbaarheid van de gegenereerde klinische gegevens te garanderen. De controles van de keuringsinstanties moeten leiden tot een hogere kwaliteit van het evaluatieproces van nieuwe medische hulpmiddelen en het wegnemen van belangenconflicten. Beide maatregelen moeten vookómen dat onveilige medische technieken op de markt komen. De televisie-uitzending van Radar waarin toezichthouders positief oordeelden over de CE-certificering van een mandarijnennetje voor gebruik als bekkenbodemmatje, staat hierbij nog vers in het geheugen. EUDAMED, een EU-brede database, is de basis voor de zogeheten post-market surveillance waarin de prestatie en de veiligheid van een medische techniek gedurende de gehele levensduur wordt bijgehouden. Zowel zorgverleners als patiënten kunnen deze database raadplegen.
Behalve dat we straks als zorgprofessionals beter kunnen vertrouwen op de kwaliteit en effectiviteit van een nieuw medisch hulpmiddel vragen de ontwikkelingen ook een inzet van artsen. Per 1 januari 2020 is het verplicht om alle geplaatste implantaten in het Landelijke Implantatenregister (LIR) te registreren. Hierin kunnen patiënt en zorgverlener bijwerkingen melden. Bij een veiligheidsrisico kunnen individuele patiënten vervolgens snel worden opgespoord.
Er is een toenemende druk vanuit de beroepsgroepen, beleidsmakers en patiënten om veiligheid, effectiviteit en kosten te verantwoorden. De kennis van de leidraad NIKP, de aankomende wetgeving en het LIR kunnen dan ook niet worden onderschat: elke arts zal er op termijn mee in aanraking komen.
Voetnoten
1. Lawsuit Settled Over Heart Valve Implicated in About 300 Deaths. The New York Times. 1992;
2. van der Graaf Y, de Waard F, van Herwerden LA, Defauw J. Risk of strut fracture of Björk-Shiley valves. Lancet (London, England). 1992; 339 (8788): 257-61.
3. Martindale V, Menache A. The PIP scandal: an analysis of the process of quality control that failed to safeguard women from the health risks. J R Soc Med. 2013; 106 (5): 173-7.
4. https://www.orthopeden.org/kwaliteit/kwaliteitsbeleid/mom-heupprothese.
5. Cohen D. How safe are metal-on-metal hip implants? BMJ. 2012; 344: e1410.
6. Rosenberg E, Berkhout K. Patiënten wisten niet dat ze proefkonijnen waren. NRC Handelsblad. 2016;
7. Rosenberg E, Berkhout K. Inspectie kritisch over Rotterdamse ballonstudie. NRC Handelsblad. 2017;
8. Leidraad NIKP. Nieuwe Interventies in de Klinische Praktijk. Orde van Medisch Specialisten en Zorginstituut Nederland. 2014;
9. Holewijn RM, de Kleuver M, van der Veen AJ, Emanuel KS, Bisschop A, Stadhouder A, e.a. A Novel Spinal Implant for Fusionless Scoliosis Correction: A Biomechanical Analysis of the Motion Preserving Properties of a Posterior Periapical Concave Distraction Device. Glob Spine J. 2017; 7 (5): 400-9.
10. Verordening (EU) 2017/745. 5 april 2017. www.ec.europa.eu/growth/sectors/medical-devices/regulatory-framework_nl.
11. http://www.ccmo.nl/nl/europese-verordeningen-medische-hulpmiddelen-en-in-vitro-diagnostica.
auteurs
Roderick Holewijn, MSc, arts-onderzoeker, Amsterdam UMC, afdeling Orthopedie
Agnita Stadhouder, orthopedisch chirurg, Amsterdam UMC, afdeling Orthopedie
prof. dr. Marinus de Kleuver, afdelingshoofd, hoogleraar orthopedie en orthopedisch chirurg, Radboudumc, Nijmegen
contact
marinus.dekleuver@radboudumc.nl
cc: redactie@medischcontact.nl
Geen belangenverstrengeling gemeld door de auteurs.
Lees ook:















Wim van der Pol
Apotheker niet praktiserend, Delft
het bekende grapje van een chirurg die een patiënt die voor het eerst geopereerd wordt, geruststelt met de woorden dat het voor hem ook de eerste keer is. Ik vind dat echte innovaties gerekend moeten worden tot experimentele geneeskunde tot in een ve...rgelijkend onderzoek het bewijs als innovatie wordt geleverd.