Informed consent is semispoedonderzoek tot last
Laat toestemmingsvereiste bij onderzoek op ic met semispoedkarakter los
2 reactiesDe regels voor het instemmen met onderzoek in semi-spoed-situaties voldoen niet. Aan patiënten of naasten toestemming vragen, is onmogelijk of onnodig. Om dit onderzoek toch mogelijk te maken zou de toestemmingsvereiste moeten vervallen, vindt de Commissie Mensgebonden Onderzoek.
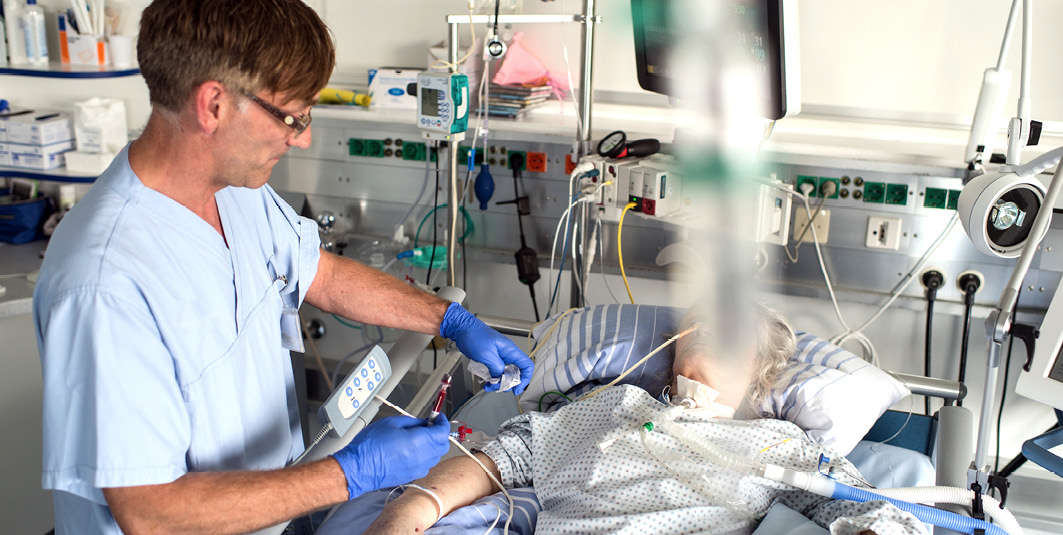
Patiënten op de intensive care kunnen levensbedreigend ziek zijn, bijvoorbeeld door sepsis. Een deel van hen overlijdt, of loopt gezondheidsschade op, soms ook door de behandeling. Daarom wordt op de ic wetenschappelijk onderzoek naar nieuwe behandelingen verricht. Probleem hierbij is dat ic-patiënten door hun levensbedreigende ziekte of de behandeling deelname aan dit onderzoek meestal niet goed kunnen afwegen. Dit geldt ook voor naasten. Zij zijn weliswaar bevoegd plaatsvervangend toestemming te ver-lenen, maar hun beslisvaardigheid staat onder druk doordat ze blootstaan aan stress. De kans is reëel dat zij onnadenkend instemmen met deelname, erop vertrouwend dat een arts-onderzoeker in de gegeven, kritieke omstandigheden niets doet wat niet in het belang van de patiënt is.1
Deelname aan onderzoek zonder informed consent lijkt echter geen optie. Weliswaar biedt de Wet medisch-wetenschappelijk onderzoek met mensen (WMO) deze mogelijkheid, maar dan moet het gaan om onderzoek in noodsituaties, waar onmiddellijk mee moet worden gestart, patiënten niet aanspreekbaar zijn en naasten doorgaans niet aanwezig zijn. Bijvoorbeeld een onderzoek naar een nieuw anti-aritmicum bij patiënten in de acute fase van een hartstilstand.
Bij onderzoek op de ic gaat het weliswaar om een levensbedreigende ziekte, maar zijn naasten doorgaans ter plekke en er moet wel onder tijdsdruk, maar niet acuut met de te beproeven behandeling worden begonnen. Er is met andere woorden hooguit sprake van een seminoodsituatie. Een voorbeeld is een placebogecontroleerd onderzoek waarbij een deel van de sepsispatiënten een experimenteel middel krijgt, bovenop de standaard-behandeling met onder meer vasopressoren. Het experimentele middel moet de duur van de standaard-behandeling bekorten en de kans op bijwerkingen beperken.2
Informed consent is geen doel op zich
De WMO voorziet niet in dit soort onderzoek. Doorgaans worden patiënten daarom ingesloten op basis van informed consent van naasten. Wij stellen een alternatief voor, dat recht doet aan de bijzondere situatie, verenigbaar is met de WMO en dus ook direct toepasbaar is. Eerst gaan we echter in op de problemen bij het includeren van patiënten in seminoodsituaties op basis van informed consent.
Verplichte bedenktijd
Een informed-consentprocedure vergt een zekere bedenktijd omdat naasten de informatie moeten verwerken en bespreken voordat ze toestemming kunnen verlenen. Bovendien moet de arts-onderzoeker verifiëren of de informatie in al zijn facetten goed is begrepen.3
Zonder bedenktijd is niet zeker dat het verlenen van toestemming een weloverwogen beslissing is. Terloops gegeven toestemming is niet rechtsgeldig.
De bedenktijd kan ten koste gaan van het therapeutische karakter van het onderzoek. In het voorbeeld van het experimentele middel voor sepsispatiënten moet de onderzoeksmedicatie liefst zo snel mogelijk na het starten van de standaardbehandeling worden toegediend om het beste effect te bereiken. Wordt het toedienen vertraagd, dan is niet alleen de kans kleiner dat de medicatie de patiënt ten goede komt, maar bovendien kunnen mogelijke bijwerkingen zwaarder wegen. Die bijwerkingen kunnen dan immers minder goed worden gerechtvaardigd met een beroep op de mogelijk gunstige werking van de onderzoeksmedicatie.
Alternatief
Wij pleiten ervoor om aan naasten geen toestemming te vragen voor deelname aan onderzoek in seminoodsituaties. Dit betekent niet dat ze volledig buiten beeld moeten blijven. Naasten (en zo mogelijk ook patiënten zelf) moeten naar hun bevattingsvermogen en informatiebehoefte en voor zover de tijd dit toelaat worden geïnformeerd over het onderzoek. Blijken er bij naasten (of patiënten) aarzelingen of bezwaren te bestaan, dan blijft deelname achterwege. Bij het geven van informatie moet een arts of een verpleegkundige worden betrokken, die geen belang heeft bij het insluiten van patiënten in het onderzoek. Dat waarborgt dat de individuele informatiebehoefte goed wordt ingeschat en dat signalen die wijzen op aarzelingen bij naasten (of patiënten) worden opgepikt.
Pas nadat de imminente bedreiging van de gezondheid is geweken, moet toestemming worden gevraagd. Die vraag betreft dan het vervolg van de deelname aan het onderzoek en is vooral aan de orde als nog steeds met het oog op het onderzoek handelingen of metingen moeten worden verricht die niet zonder risico of belasting zijn. Er is dus geen toestemming meer nodig als een patiënt onverhoopt is overleden. Data die in de semiacute fase zonder toestemming gegenereerd zijn, mogen in elk geval voor het onderzoek worden gebruikt.⁴
Verenigbaar met WMO
Dit voorstel sluit aan bij wat in de WMO is bepaald.
De informed-consentvereiste in de WMO is niet absoluut; in noodsituaties mag ervan worden afgeweken.
Informed consent is geen doel op zich, maar een middel om recht te doen aan de autonomie van patiënten.⁵ In seminoodsituaties biedt dit middel echter geen zekerheid dat een besluit over deelname weloverwogen is genomen, zeker niet als de bedenktijd kort is.
De WMO beoogt patiënten zoveel mogelijk overeenkomstig hun (vermoedelijke) wil aan onderzoek te laten deelnemen. De voorgestelde werkwijze geeft binnen de gegeven beperkingen uitdrukking aan dit streven.
De WMO schrijft voor dat betrokkenen voor vragen en inlichtingen terechtkunnen bij iemand met verstand van zaken buiten het onderzoek. Door een onafhankelijke arts of een verpleegkundige bij het onderzoek te betrekken, wordt aan dit voorschrift recht gedaan.
Door de voorgestelde procedure wordt het toedienen van de studiemedicatie niet vertraagd. Daardoor kunnen patiënten voluit therapeutisch voordeel van deelname ondervinden en mogen de bijwerkingen van de studiemedicatie eerder op de koop toe worden genomen. Dit betekent dat aan deelname voor patiënten per saldo minder nadelen verbonden zijn.
De voorgestelde procedure draagt bij aan de relevantie van het onderzoek. Als de studiemedicatie snel kan worden toegediend, dan wordt de klinische praktijk waarin de medicatie op termijn zijn plaats moet krijgen, beter benaderd.
Frans van Agt, jurist, Radboudumc en Commissie Mensgebonden Onderzoek (CMO) regio Arnhem-Nijmegen
Lianne Damen, secretaris van CMO regio Arnhem-Nijmegen
Ronald Keus, radiotherapeut, vicevoorzitter van CMO regio Arnhem-Nijmegen
Evert van Leeuwen, hoogleraar medische ethiek, voorzitter van CMO regio Arnhem-Nijmegen
Contact:
cc: redactie@medischcontact.nl
Geen belangenverstrengeling gemeld door de auteurs
Voetnoten
1. Kompanje EJO, Jansen TC, Le Noble JLML, De Geus HR, Bakker J. Uitgestelde toestemming voor inclusive van beslissingsonbekwame patiënten in studies van spoedeisende geneeskunde. Ned Tijdschrift Geneeskd 2008, 20 september; 152 (38), 2060.
2. Selepressin Evaluation Programme for Sepsis-induced Shock - Adaptive Clinical Trial (SEPSIS-ACT), ClinicalsTrials.gov Identifier: NCT02508649, www.clinicaltrials.gov.
3. Schmidt TA et al. Confronting the Ethical Challenges to informed Consent in Emergency Medicine Research. Acad Emerg Med, 2004, (11) 10: 1087.
4. Jansen TC, Kompanje EJO, Bakker J. Deferred proxy consent in emergency critical care research: Ethically valid and practically feasible. Crit Care Med 2009; (37), 1: 67.
5. Largent EA, Wendler D, Emanuel E, Miller FG. Is Emergency Research Without Initial Consent Justified? Arch Intern Med, 170 (8), April 26, 210: 669.
Download dit artikel (pdf)














Martine de Vries
Kinderarts, Leiden
Een discussie over de regelgeving rondom (semi)spoedonderzoek is essentieel om dit gebied verder te ontwikkelen. Ik begrijp echter niet waarom de auteurs daarbij in sommige situaties kiezen voor een complete "waiver" van consent (het geheel achterweg...e laten van toestemming) in plaats van voor een "deferred" consent (uitstel van toestemming).
De WMO geeft daar mijns inziens geen ruimte voor. Handelingen ter uitvoering van spoedonderzoek mogen alleen plaatsvinden zonder toestemming ZOLANG de omstandigheid die de verhindering van het geven van toestemming vormt, zich voordoet. Dit geeft ruimte voor een "deferral" maar niet voor een "waiver". Zodra de patient of de nabestaanden in staat zijn tot het geven van toestemming moet deze verkregen worden. Dit geldt ook voor het gebruik van data. De patient of de nabestaanden moeten de kans krijgen om data gebruik te weigeren nadat het zonder toestemming is verkregen. Waar zijn we bang voor? Dat nabestaanden het overlijden van hun familielid gaan wijten aan deelname aan de studie? Transparantie over onderzoeksactiviteiten en het gebruik van data is essentieel om het vertrouwen in de zorg te behouden.
Maarten Vasbinder
medico familiar e comunitario, Ubon Ratchathani
Waarom dit niet in een codicil regelen. Daarbij zou een nationaal codicil register moeten worden opgebouwd, dat online kan worden geraadpleegd.
Wie niet mee wil doen aan onderzoek, kan dat in het codicil vastleggen, of andersom, als de politiek dat ...zo beslist.
Wie zwijgt (geen codicil), stemt toe lijkt me in dit geval een goed uitgangspunt.
Als er geen tijd is, dan breekt nood wet.