Genmodificatie op menselijke embryo’s gelukt
Plaats een reactieOnderzoekers hebben menselijke embryo’s behandeld waardoor een genetische afwijking in de meeste gevallen verdween. Hong Ma e.a. schrijven over deze succesvolle genmodificatie met CRISPR-Cas in Nature. Vijf vragen over dit onderzoek dat als doorbraak wordt gezien.
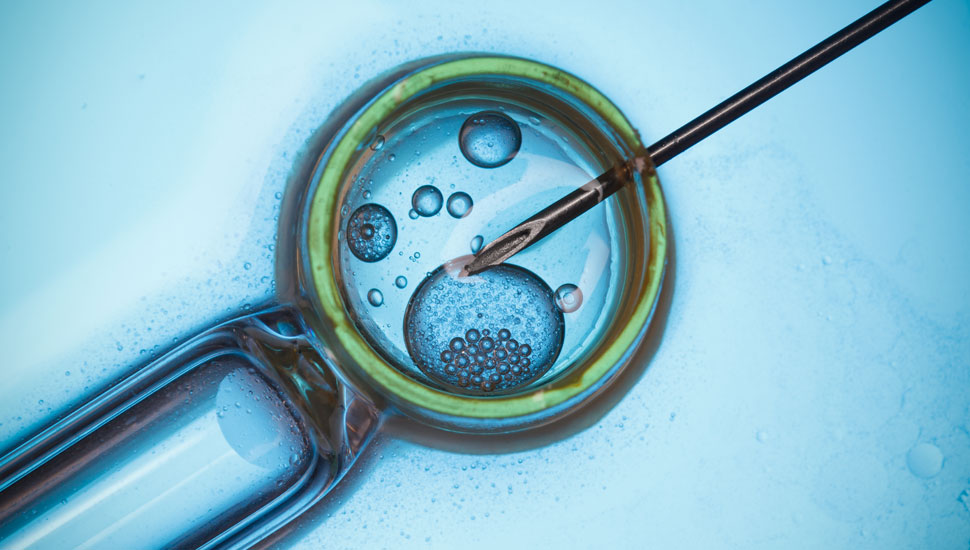
Wat is er precies gebeurd?
Onderzoekers uit de VS, Zuid-Korea en China werkten samen bij dit project, waarbij het doel was menselijke embryo’s zonder een bepaalde genetische afwijking te laten ontstaan. De onderzoekers hebben in oöcyten van vrouwen zonder de genetische afwijking sperma geïnjecteerd van een man met erfelijke hypertrofische cardiomyopathie. Bij hem was sprake van een heterozygote, dominante afwijking in het zogenaamde MYBPC3-gen. Bij toevoeging van zijn sperma aan gezonde oöcyten was ongeveer de helft van de embryo’s die ontstonden zoals verwacht aangedaan. In het experiment voegden de onderzoekers zijn sperma toe aan oöcyten, maar dan samen met CRISPR-Cas9-constructen die op de mutatie aangrepen. Dit gebeurde door een stuk RNA te hangen aan het Cas-eiwit dat een breuk in DNA kan aanbrengen. Het doel: het gemuteerde gen wegknippen, en DNA-reparatiemechanismen de rotzooi op laten ruimen. Dat lukte, maar in eerste instantie was er bij een relatief groot deel van de embryo’s sprake van mozaïcisme; die bevatten cellen met twee gezonde genen én cellen met zowel normaal als een afwijkend gen. Door het experiment te herhalen in een andere fase van de celcyclus, werd dit probleem grotendeels omzeild. Van 58 embryo’s waren er 42 homozygoot, met twee gezonde genen. Na het wegknippen van het afwijkende gen, herstelde het DNA zich in vrijwel alle gevallen naar voorbeeld van het goede gen van de moeder. In 16 embryo’s had helemaal geen reparatie plaatsgevonden.
Er zijn toch eerder onderzoeken op embryo’s gedaan? Wat is hier zo bijzonder aan?
Er is een andere techniek gebruikt: er is niet in een reeds bevruchte eicel oftewel een zygote ingegrepen, maar CRISPR-Cas9 is met sperma gelijk ingespoten. Door dit op het juiste moment te doen, kan het optreden van mozaïcisme verminderen.
Nog een belangrijk onderscheid: in eerdere onderzoeken werden geen levensvatbare embryo’s gebruikt, hiervoor wel. Net als ‘normale’ embryo’s zoals die bijvoorbeeld voor ivf worden ontwikkeld, bereikte ongeveer de helft van de bewerkte embryo’s de blastocystefase, het moment waarop celdifferentiatie optreedt. Dat lijkt erop te wijzen dat de ontwikkeling niet wordt verstoord door deze genmodificatie. Verder vonden de onderzoekers geen onverwachte veranderingen in het DNA, zogenaamde off-targeteffecten.
Verandert dit onderzoek het perspectief van mensen met vergelijkbare, monogenetische aandoeningen?
‘Kort gezegd: nee’, zegt Edwin Cuppen, hoogleraar humane genetica UMC Utrecht. ‘Want in dit soort gevallen kunnen we al met pre-implantatie genetische diagnostiek (pgd) ervoor zorgen dat alleen gezonde embryo’s bij de moeder worden teruggeplaatst. Met deze techniek kun je meer gezonde embryo’s creëren, maar gezien de vele onzekerheden zou ik niemand aanraden om dat nu al daadwerkelijk toe te passen. Dan doel ik bijvoorbeeld op het risico van off-targeteffecten: dat CRISPR-Cas onbedoeld verkeerde stukjes DNA wegknipt. In dit experiment lijkt het niet te gebeuren, maar dat is nog te onzeker.’ Slechts in uitzonderlijke gevallen zou deze techniek toepasbaar zijn, zegt Cuppen.
Kan dergelijk onderzoek in Nederland ook plaatsvinden?
‘Nee, dat staat de huidige Embryowet niet toe’, zegt Cuppen, ‘Die laat het niet toe dat we embryo’s laten ontstaan met als doel wetenschappelijk onderzoek, daarvoor mogen alleen restembryo’s worden gebruikt. En die zijn al bevrucht.’ Demissionair minister Schippers zei vorig jaar wel de Embryowet te willen aanpassen om dit mogelijk te maken, maar met de beperking dat het alleen om onderzoek zou mogen gaan met directe klinische relevantie. In andere landen gelden dergelijke beperkingen niet, waardoor bepaalde ontwikkelingen met CRISPR-Cas daar sneller gaan dan hier. Het is overigens niet zo dat de techniek aan Nederland voorbijgaat. Cuppen: ‘Deze wordt heel veel gebruikt in researchsettings, maar dan op bijvoorbeeld celkweken, of in organoïden. We kunnen met CRISPR-Cas in een stamcel een tumoreigenschap aanbrengen, en deze vervolgens bestuderen in het weefsel dat we daaruit kweken.’
Dit onderzoek ging over het herstellen van ziekte, betekent dit iets voor het eventuele verbeteren van menselijke eigenschappen?
‘Daar moeten we goed over nadenken, want uiteindelijk zal het wel mogelijk zijn om bijvoorbeeld eigenschappen die een relatie hebben met gedrag of intelligentie aan te passen door genmodificatie. Dat is nu nog niet mogelijk, maar het komt ongetwijfeld.’ In dit onderzoek bleek overigens dat het toevoegen van een compleet nieuwe eigenschap nog niet zo eenvoudig zal zijn: bij het inspuiten van de oöcyten werd ook een ‘mal’ meegestuurd, een stukje RNA dat had kunnen dienen als voorbeeld voor DNA-herstel. In slechts één geval werd dat gebruikt, in de overige gevallen was het moederlijke gen als voorbeeld gebruikt. Cuppen: ‘Dat is niet vreemd, we weten dat het verschil maakt in welk celtype en in welke fase van de celcyclus je ingrijpt. Afhankelijk daarvan heeft de cel voorkeur voor ofwel het homologe voorbeeld, of een toegevoegde mal. Maar het toont wel aan dat deze techniek veel haken en ogen heeft.’
Nature, 2017. http://nature.com/articles/doi:10.1038/nature23305
Lees ook- Er zijn nog geen reacties

















