Coronavaccins, bijwerkingen en veiligheid
Nederlands meldsysteem werkt goed en levert veel nuttige kennis op
Plaats een reactie
Bijwerkingencentrum Lareb ontving meer dan 220 duizend meldingen over bijwerkingen na een coronavaccinatie. Wat leveren registratie, analyse en duiding hiervan op? Een verslag van binnenuit.
De meeste meldingen van bijwerkingen, zo’n 212.500 (96%), waren afkomstig van gevaccineerden, maar ook zo’n 7500 van zorgverleners. Met een meldingsgraad van circa zes per duizend toegediende coronavaccins is Nederland internationaal koploper. Maar wat is het belang van deze veiligheidsbewaking en wat heeft het tot nu toe opgeleverd?
Kracht van het meldsysteem
Net als geneesmiddelen worden vaccins – dus ook coronavaccins – zorgvuldig beoordeeld op werkzaamheid, veiligheid en kwaliteit voordat registratie kan plaatsvinden. Daar gelden strenge eisen voor. Zo zijn ze vóór registratie in relatief grote trials onderzocht. Maar omdat sommige bijwerkingen pas aan het licht komen bij vaccinatie op grote schaal en aan een diverse groep, wordt de veiligheid na markttoelating goed bewaakt. De meldsystemen voor vermoedens van bijwerkingen hebben jarenlang bewezen veiligheidssignalen te kunnen detecteren. De kracht van het meldsysteem is dat een optelsom van vermoedens, na goede analyses, nieuwe inzichten in bijwerkingen kan geven. Door het melden ervan komen klinische observaties van zorgverleners en ervaringen van patiënten op een centrale plek bij elkaar.
Nederland is internationaal koploper als het gaat om meldingen van bijwerkingen van coronavaccins.
Nederland en Europa
Als meldingen qua aard en aantal daar aanleiding toe geven, voert Lareb een analyse uit. Daarbij kijkt het naar het aantal (inter)nationale meldingen, de overeenkomsten in het klinische beeld, de latentietijd (dus hoe lang het duurde voordat de klachten ontstonden), het mogelijke werkingsmechanisme, de achtergrondincidentie en mogelijke andere oorzaken. Naast het raadplegen van de wetenschappelijke literatuur wordt daarbij ook een beroep gedaan op experts zoals medisch specialisten met specifieke expertise. Als de analyse leidt tot nieuwe kennis over (mogelijke) bijwerkingen, publiceert Lareb daarover op zijn website.
Het centrum ondersteunt ook het College ter Beoordeling van Geneesmiddelen (CBG) bij diens taak in de geneesmiddelenbewaking in Nederland en Europa door het te informeren over nieuwe kennis over (mogelijke) bijwerkingen via signaleringen. Deze worden besproken met het CBG en als het vaccins betreft ook met het Rijksinstituut voor Volksgezondheid en Milieu (RIVM). Het CBG beslist vervolgens over de vervolgacties, zoals het inbrengen bij het beoordelingscomité van het Europees Geneesmiddelenbureau (EMA). Alle Europese meldcentra, en dus ook Lareb, sturen hun meldingen ook door naar de Europese databank (EudraVigilance) van het EMA. Het EMA bewaakt de veiligheid op Europees niveau.
Nieuwe kennis over bijwerkingen publiceert Lareb op zijn website
Nieuwe bijwerkingen
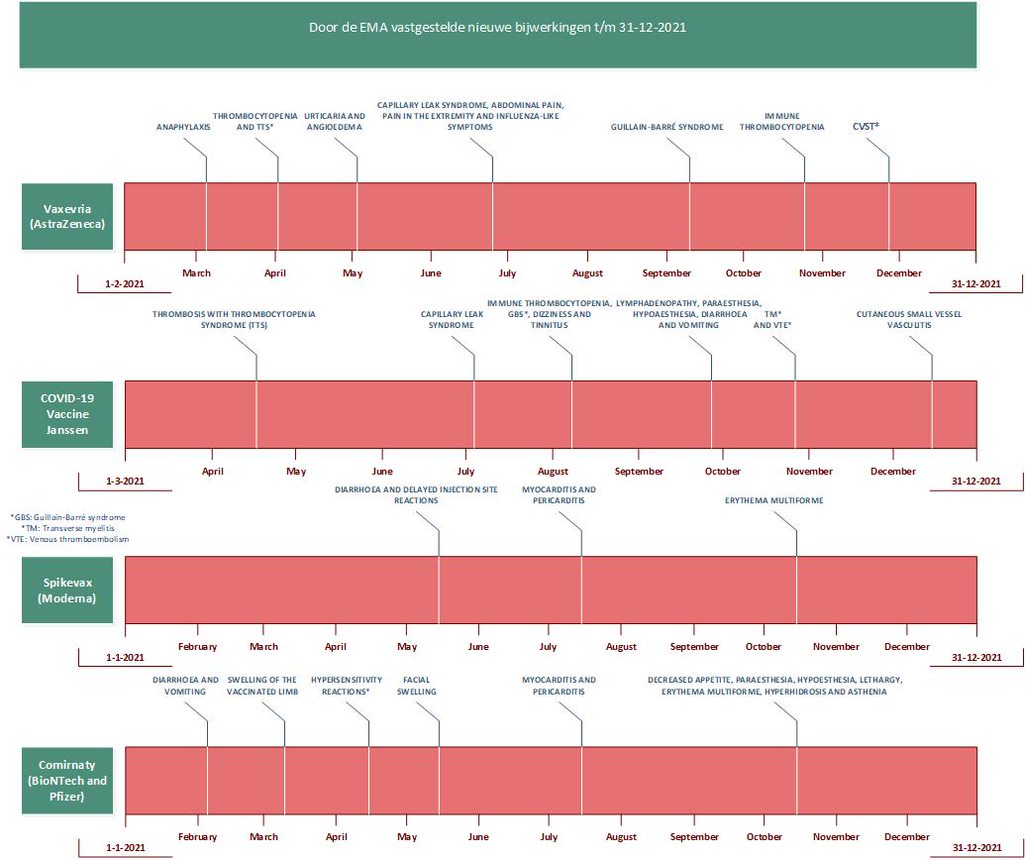
Het EMA heeft sinds de markttoelating diverse nieuwe bijwerkingen van de coronavaccins vastgesteld (zie figuur 1). Het delen van de klinische observaties in Europa was cruciaal bij het ontdekken ervan. Ernstige bijwerkingen die door het melden ontdekt zijn bij de vectorvaccins zijn bijvoorbeeld: het guillain-barrésyndroom, myelitis transversa en opvlamming van het capillaireleksyndroom. Bij de mRNA-vaccins van Pfizer/BioNTech (Comirnaty) en Moderna (Spikevax) zijn myocarditis en pericarditis voorbeelden van nieuw ontdekte ernstige bijwerkingen.
In maart 2021 kwamen er verschillende meldingen uit Europa van trombose in combinatie met een verlaagd aantal bloedplaatjes na AstraZeneca-vaccinatie. Deze meldingen betroffen voornamelijk personen onder de 55 jaar en hadden soms een fatale afloop. Het EMA besloot naar aanleiding van deze meldingen om verder onderzoek naar deze mogelijke ernstige bijwerking te doen.1 Ondertussen besloten verschillende Europese landen, waaronder ook Nederland, om tijdelijk te stoppen met dit vaccin. Het EMA stelde na zorgvuldig onderzoek vast dat trombose met trombocytopeniesyndroom (TTS) een zeldzame, maar ernstige bijwerking was van het AstraZeneca-vaccin.2 Dit leidde er in Nederland toe dat het vaccin van AstraZeneca alleen werd gegeven aan mensen ouder dan 60 jaar.3 Overigens zijn veel Europese landen (bijvoorbeeld omdat er voldoende alternatieve vaccins beschikbaar waren) wél helemaal gestopt met gebruik van AstraZeneca.
Later werd de bijwerking TTS ook vastgesteld bij het Janssen-vaccin. De snelle ontdekking van deze bijwerking was zeer cruciaal, met name ook voor het geven van de juiste behandeling. Lareb ontving 24 meldingen met sterke aanwijzingen dat het deze zeldzame bijwerking betrof. Drie mensen overleden vrijwel zeker aan deze bijwerking.
Vervolgonderzoek
Als een mogelijke bijwerking niet erg specifiek is, is het veel moelijker om conclusies te trekken op basis van meldingen. Zeker als de achtergrondincidentie relatief hoog is. Analyses van meldingen kunnen dan wel aanleiding zijn tot vervolgonderzoek. Zoals epidemiologisch onderzoek dat bekijkt of een potentiële bijwerking van vaccinatie vaker voorkomt dan voor of zonder vaccinatie. Meldingen van ‘gewone’ trombose en menstruatiestoornissen, die Lareb veelvuldig heeft ontvangen, zijn daar goede voorbeelden van.
Trombose
Het EMA concludeerde dat veneuze trombose een bijwerking is van het Janssen-vaccin. Deze bijwerking werd in de klinische trials vaker gezien bij de vaccinatiegroep dan bij de placebogroep. Sindsdien stond deze bijwerking onder extra toezicht van het EMA. Ook concludeerde het EMA dat cerebrale veneuze sinustrombose een bijwerking is van het AstraZeneca-vaccin op basis van de meldingen die hierover binnenkwamen in Europa. Tot nu toe werden er geen conclusies getrokken over andere vormen van trombose en andere coronavaccins. Bijwerkingencentrum Lareb kreeg ook veel meldingen van trombose. Uit een analyse van 2076 meldingen – waarbij het aantal meldingen van trombose dat optrad binnen twee weken na de vaccinatie werd vergeleken met de achtergrondincidentie – kon geen conclusie worden getrokken over een relatie met de coronavaccins. Bij mensen die het AstraZeneca-vaccin kregen, was het aantal meldingen van trombose soms hoger dan verwacht. Bijvoorbeeld veneuze trombose bij mannen en vrouwen jonger dan 60 jaar en ook bij vrouwen ouder dan 60 jaar. Na de eerste AstraZeneca-vaccinatie was het aantal meldingen van cerebrale veneuze sinustrombose ook hoger dan verwacht. In samenwerking met het Leids Universitair Medisch Centrum (LUMC) is Lareb nu een vervolgonderzoek gestart naar het risico op trombose en embolieën na coronavaccinaties.
Trombose met trombocytopenie-syndroom was een zeldzame, maar ernstige bijwerking van het AstraZeneca-vaccin
Menstruatiestoornissen
Lareb ontving maar liefst meer dan 24 duizend meldingen van menstruatiestoornissen na coronavaccinatie. De meldingen zijn zeer divers, maar hevige bloedingen en amenorroe waren de vaakst gemelde klachten. Naast menstruatiestoornissen werden ook postmenopauzale bloedingen meer dan 650 keer gemeld. Op basis van analyse van de meldingen blijkt dat menstruatiestoornissen en postmenopauzale bloedingen mogelijke bijwerkingen zijn. Ook hier zal Lareb een vervolgonderzoek naar doen, waarbij in een epidemiologisch onderzoek gekeken wordt of er meer consulten bij de huisarts waren door vrouwen met menstruatiestoornissen in een periode na de coronavaccinatie.
Belang van kennis
Het verzamelen, registreren en analyseren van gegevens uit meldingen over bijwerkingen van geneesmiddelen en vaccins levert kennis op die er eerder niet of onvoldoende was. Kennis die van belang is voor zorgverleners en patiënten bij de keuze voor een geneesmiddel of vaccin, maar ook voor het voorkomen, herkennen en behandelen van bijwerkingen. Daarnaast is het goed bewaken van de veiligheid van vaccins essentieel voor het vertrouwen in deze vaccins, met name in een tijd waarin er veel vragen zijn over de bijwerkingen. Daarom geeft Lareb hierover up-to-date informatie op zijn website. Ook heeft het bijwerkingencentrum een onlinekennisbank met informatie over bekende, maar ook vermeende bijwerkingen. Dit is een handig hulpmiddel voor zorgverleners om patiënten naar te verwijzen.
Transparantie over meldingen en de duiding hiervan is essentieel. Want een bijwerking signaleren is van belang, maar ook als je geen bijwerking vindt, terwijl er wel goed gezocht is, is het belangrijk om dit te vermelden. Lareb kan zijn werk alleen goed doen als er ook bij vermoedens van bijwerkingen goed gemeld wordt. Gelukkig is dat melden tot nu toe laagdrempelig verlopen. En wat ons betreft zal dat ook zo blijven.
auteurs
dr. Agnes Kant, directeur Bijwerkingencentrum Lareb, epidemioloog
dr. Florence van Hunsel, hoofd signaaldetectie Lareb
Priya Somar MsC, wetenschappelijk medewerker veiligheid van vaccins, Lareb
contact
a.kant@lareb.nl
cc: redactie@medischcontact.nl
Voetnoten
1. EMA veiligheidsupdate 29 maart 2021.
2. EMA veiligheidsupdate 14 april 2021.
3. Gezondheidsraad. Inzet AstraZeneca-vaccin. 2021; publicatie nr. 2021/17.
Lees ook-
Bekijk het dossier dossier Covid-19
- Er zijn nog geen reacties















