Resistente schimmel is onderschat probleem
Bacteriële infecties zijn beheersbaar geworden, schimmelinfecties kloppen aan de poort
Plaats een reactie
Anders dan voor antibioticaresistentie is er nauwelijks aandacht voor resistentie tegen geneesmiddelen voor schimmelinfecties. Ten onrechte, het probleem groeit en de letaliteit is fors.
In Nederland zijn we succesvol in het tegengaan van antibioticaresistentie. Deze resistentie wordt erkend als een belangrijk probleem en we slagen erin het antibioticagebruik door mensen en in de veehouderij te controleren en te reduceren.1 Ook internationaal wordt de microbiële resistentieproblematiek aangepakt. De Wereldgezondheidsorganisatie WHO geeft prioriteit aan resistentie bij bacteriële infecties inclusief tuberculose, resistentie bij malaria en influenza.2
Heel anders staat het met de aandacht voor de moeilijkheden bij de behandeling van invasieve aspergillose, een infectie met Aspergillus fumigatus waarbij de schimmel het longweefsel aantast. Deze infectie komt voor bij naar schatting zeshonderd patiënten per jaar.
De behandelopties bij invasieve aspergillose zijn bij voorbaat al zeer beperkt
Internationale richtlijnen bevelen de azolen voriconazol of isavuconazol aan voor patiënten met invasieve aspergillose. Maar in Nederland wordt dit niet meer in alle gevallen veilig geacht. Hier start men doorgaans met een combinatietherapie: de azolen voriconazol of isavuconazol in combinatie met liposomaal amfotericine B of met een echinocandine, ten minste totdat de azoolgevoeligheid bekend is.3 Alleen niet-ernstige patiënten bij wie de resultaten van resistentieonderzoek snel beschikbaar zijn, kunnen met alleen een azool starten. De reden om af te wijken van de internationale richtlijnen is de hoge mate van resistentie bij de belangrijkste verwekker van deze ziekte, Aspergillus fumigatus. Onderzoek bij bijna drieduizend patiënten liet zien dat 12,9 procent van de gekweekte A. fumigatus-stammen resistent is tegen azolen.4 Patiënten met invasieve aspergillose ontwikkelen resistentie als ze sporen inademen die reeds resistent zijn tegen azolen.5 6 Resistente sporen ontstaan op plaatsen waar A. fumigatus zich actief kan vermeerderen en waar residuen van azoolfungiciden aanwezig zijn. Azoolfungiciden zijn schimmelbestrijders op basis van azolen waarvan sommige verwant zijn aan de medische azolen.7 Door mutaties ontwikkelt A. fumigatus resistentie tegen deze fungiciden; omdat er kruisresistentie bestaat tegen de medische azolen, is deze medicatie niet meer effectief voor de behandeling van patiënten die geïnfecteerd zijn met een resistente schimmel.8
De impact hiervan is heel groot. Patiënten met een resistente schimmelinfectie hebben een aanzienlijk hogere sterftekans dan patiënten met een A. fumigatus-infectie die wel gevoelig is voor azolen.9
Onbehandelbaartabel
In Nederlandse umc’s is azolenresistentie bij A. fumigatus mogelijk een groter probleem dan de resistentie bij bacteriële infecties. In het Radboudumc werd de resistentie van patiënten met bacteriële infecties vergeleken met die van patiënten met invasieve aspergillose. De mate van resistentie bleek het hoogst bij A. fumigatus, hoger dan die bij MRSA of ESBL (zie tabel).
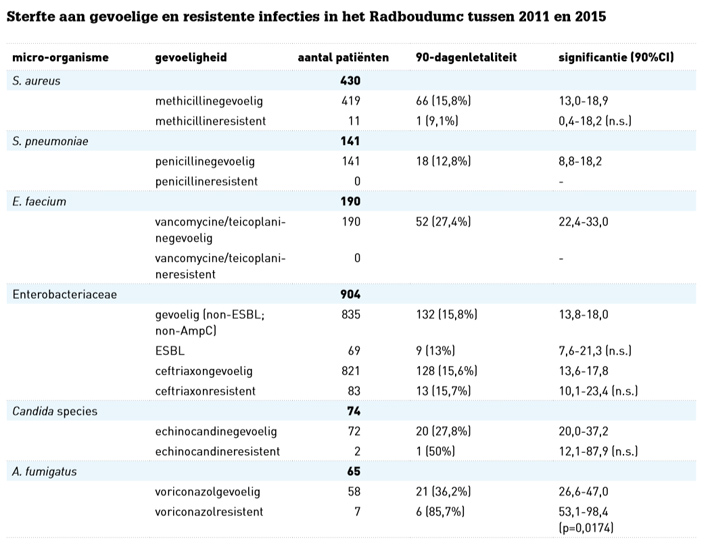
Daarnaast bleek dat de sterfte door bacteriële infecties die resistent waren niet verschilde van de sterfte door infecties die gevoelig waren voor antibiotica. Maar de sterfte door een azolenresistente invasieve aspergillose was significant hoger dan die door een azolengevoelige infectie (86% versus 36%, p=0,0174).9 Kennelijk zijn er bij bacteriële resistentie nog genoeg andere manieren om de infectie te behandelen. De behandelopties bij invasieve aspergillose zijn bij voorbaat al zeer beperkt, namelijk azolen of liposomaal amfotericine B. Sommige vormen van invasieve aspergillose, zoals voriconazolresistente cerebrale aspergillose, zijn zelfs onbehandelbaar.10
Er zijn aanwijzingen dat uitstel van effectieve therapie, bijvoorbeeld door het geven van voriconazol aan een patiënt met voriconazolresistente invasieve aspergillose, de sterftekans vergroot ook al wordt na het vaststellen van resistentie de therapie aangepast. Kostbare tijd gaat verloren als resistentie op basis van een kweek moet worden vastgesteld. Er is dringend behoefte aan testen die vroeg in het infectieproces resistentie kunnen aantonen of uitsluiten. Probleem hierbij is dat veel resistentiemutaties nog niet bekend zijn en dus niet met een PCR-test zijn aan te tonen.
Hoge prioriteit
Nederland heeft een voortrekkersrol als het gaat om het managen van antibioticaresistentie. Het is belangrijk nu ook het probleem van schimmelresistentie aan te pakken. In de afgelopen twaalf jaar is binnen het infectieziektebestrijdingsprogramma van ZonMw aan 114 projecten subsidie toegekend. Slechts één (0,9%) hiervan betrof onderzoek naar schimmelinfecties. Sommige programma’s die zich specifiek richten op antimicrobiële resistentie, zoals het Priority Medicine Antimicrobiële Resistentie-programma en het huidige antibioticaresistentieprogramma, sluiten projectvoorstellen die zich richten op schimmelresistentie zelfs uit. De noodzaak om de resistentiemechanismen van A. fumigatus in kaart te brengen en betere diagnostische testen te ontwikkelen is groot en vereist dat schimmelonderzoek een hoge prioriteit krijgt.
Organisch afval
Het gebruik van azolenfungiciden in het milieu is een belangrijke bron voor resistente A. fumigatus-sporen. Azoolfungiciden worden bijvoorbeeld gebruikt om gewassen, geoogste citrusvruchten en natuurlijke materialen zoals hout te beschermen. Omdat A. fumigatus geen ziekteverwekker is voor planten, maar groeit op organisch afval (compost) is de toepassing van de fungiciden niet gericht op A. fumigatus en wordt de schimmel niet meegenomen in landbouwkundig resistentieonderzoek en surveillance. Het is niet duidelijk waarom deze problemen niet in andere landen voorkomen. Naar aanleiding van Kamervragen hebben de ministeries van Volksgezondheid, Welzijn en Sport en van Landbouw, Natuur en Voedselkwaliteit onderzoek laten doen naar potentiële bronnen van resistente A. fumigatus in het milieu. Uit dit onderzoek blijkt dat de aanwezigheid van azoolfungiciden inderdaad bijdragen aan resistentie bij A. fumigatus, en dat met name organisch afval dat residuen van azoolfungiciden bevat, resistentie faciliteert.7 11 Resistente A. fumigatus werd gevonden in groenafval, afval van de bloembollenteelt en in houtafval, waar in alle gevallen ook residuen van azoolfungiciden werden aangetroffen. Omdat er nog geen link is gelegd tussen resistentiebron en infectie bij de mens, is het belangrijk om te onderzoeken welke bronnen bijdragen aan resistentie bij de mens en welke maatregelen de resistentiedruk in het milieu kunnen verminderen. Deze vragen vereisen multidisciplinair onderzoek vanuit een ‘One Health’-perspectief, maar het begint bij de erkenning dat er een probleem is met de behandeling van patiënten met schimmelinfecties in Nederland.
Kweek
Resistentie tegen azolen is aan te tonen door in vitro gevoeligheidsonderzoek te doen van een positieve kweek. Bij de meeste patiëntengroepen is de opbrengst van een kweek echter laag, waardoor er geen isolaat is om resistentie op te testen. Een recent cohortonderzoek onder hematologiepatiënten in het Radboudumc liet zien dat bij minder dan 6 procent van de patiënten de schimmel werd gekweekt. Als de kweek negatief is, kan men nog proberen om het DNA van de schimmel te testen met een PCR-test om de aanwezigheid van resistentiemutaties aan te tonen. Er bestaan commerciële PCR-testen die resistentiemutaties direct in klinisch materiaal kunnen aantonen, maar deze testen hebben een beperkte gevoeligheid en tonen niet alle bekende resistentiemutaties aan.
Het diagnosticeren wordt verder bemoeilijkt door de aanwezigheid van menginfecties. Hierbij is sprake van een infectie van een azolengevoelige stam en van een resistente stam. Bij kweekpositieve patiënten moeten meerdere individuele kolonies worden onderzocht op de aanwezigheid van resistentie. Resistentieonderzoek van bacteriën is gemeengoed in klinisch microbiologische laboratoria in Nederland, maar dat is niethet geval voor filamenteuze schimmels die voor resistentiebepaling vaak worden opgestuurd naar een referentielaboratorium. Door de beperkte diagnostische mogelijkheden is het moeilijk resistentie aan te tonen of uit te sluiten. Hierdoor moeten veel patiënten worden doorbehandeld met combinatietherapie. Combinatietherapie gaat gepaard met meer kans op bijwerkingen, op geneesmiddelinteracties en hogere kosten.
auteurs
Paul Verweij
afdeling Medische Microbiologie, Radboudumc, Nijmegen, Expertisecentrum Schimmelinfecties Radboudumc/CWZ
Roger Brüggemann
afdeling Klinische Farmacie, Radboudumc, Nijmegen, Expertisecentrum Schimmelinfecties Radboudumc/CWZ
Jacques Meis
afdeling Medische Microbiologie en Infectieziekten, CWZ, Nijmegen, Expertisecentrum Schimmelinfecties Radboudumc/CWZ
Frank van de Veerdonk
afdeling Inwendige Ziekten, Radboudumc, Nijmegen, Expertisecentrum Schimmelinfecties Radboudumc/CWZ
contact
paul.verweij@radboudumc.nl; cc: redactie@medischcontact.nl
Geen belangenverstrengeling gemeld door de auteurs.
voetnoten
1. https://www.rijksoverheid.nl/onderwerpen/antibioticaresistentie.
2. WHO global action plan on antimicrobial resistance. (http://www.who.int/antimicrobial-resistance/publications/global-action-plan/en/.)
3. SWAB guidelines for the management of invasive fungal infections. (http://www.swab.nl/swab/cms3.nsf/uploads/3AA7A56CE879587BC12581F80061297F/$FILE/SWAB%20Richtlijn%20Mycosen%202017%20(final).pdf.)
4. Aspergillus fumigatus. In: de Greeff SC, Mouton JW. NethMap 2017. Consumption of antimicrobial agents and antimicrobial resistance among medically important bacteria in the Netherlands. Bilthoven, 149-51.
5. van der Linden JW, Snelders E, Kampinga GA, e.a. Clinical implications of azole resistance in Aspergillus fumigatus, The Netherlands, 2007-2009. Emerg Infect Dis. 2011;17:1846-54
6. van de Veerdonk FL, Kolwijck E, Lestrade PPA, et al. Influenza-associated aspergillosis in critically ill patients. Am J Resp Crit Care Med 2017; 196: 524-7.
7. Triazolenresistentie Aspergillus. https://www.tweedekamer.nl/kamerstukken/brieven_regering/detail?id=2017Z16992&did=2017D35356
8. Verweij PE, Snelders E, Kema GH, Mellado E, Melchers WJ. Azole resistance in Aspergillus fumigatus: a side-effect of environmental fungicide use? Lancet Infect Dis 2009; 9: 789-95.
9. Lestrade PPA, Bentvelsen RG, Schalekamp S, e.a. Retrospective observational cohort study comparing the management and outcome of culture-positive invasive aspergillosis due to Aspergillus fumigatus with wildtype and non-wildtype triazole susceptibility. ECCMID 2017 abstract OS0742.
10. van der Linden JW, Jansen RR, Bresters D e.a. Azole-resistant central nervous system aspergillosis. Clin Infect Dis 2009; 48: 1111-3.
11. Zhang J, van den Heuvel J, Debets AJM, et al. Evolution of cross-resistance to medical triazoles in Aspergillus fumigatus through selection pressure of environmental fungicides. Proc R Soc B 2017;284:2017635.
download dit artikel (pdf)- Er zijn nog geen reacties
















